
科目:gzhx 来源:同步题 题型:单选题

科目:gzhx 来源:同步题 题型:填空题
 2NH3(g)(正反应为放热反应),如下图所示是某一时间段中反应速率与反应进程的曲线关系。回答下列问题:
2NH3(g)(正反应为放热反应),如下图所示是某一时间段中反应速率与反应进程的曲线关系。回答下列问题: 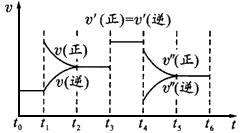
科目:gzhx 来源:物理教研室 题型:022
如下图所示是一种氢——氧燃料电池的工作原理图,其电解质为有机高分子聚合物:
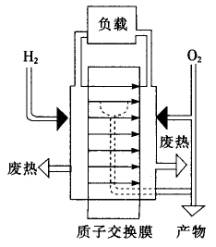
(1)燃料电池中质子交换膜的作用是________________________.
(2)写出氢氧燃料电池正负极发生的电极反应式(注明是氧化反应还是还原反应)和电池的总反应方程式___________________________.
(3)若用燃料电池发电,输出电流的电流强度为533 A,则每小时能合成多少水?
(4)电池燃料氢可利用甲醇、天然气、石油、柴油等,通过一个氢气变换器而得到.写出利用天然气转化为氢气的化学方程式___________________.
(5)请根据文中质子交换膜燃料电池工作原理图,说明负载的电流方向为__________________.
(6)用某种燃料电池给电炉供电,设电炉的额定功率P0=400 W,电池在不接负载时的路端电压与电炉的额定电压相同,当电炉接到该电源上时,电炉实际消耗的功率P1=324W.若两个这样的炉并联接到该电源上,求两个电炉实际消耗的总功率P2为多少?
科目:gzhx 来源: 题型:022
被誉为改变未来世界的十大科技之一的燃料电池是一种新型的无污染、无噪音、高效率的汽车动力和发电设备,正以势不可挡之势挤入汽车工业和电力工业.它是一种不经过燃烧,将燃料的化学能直接转换成电能的装置.这主要由燃料、氧化剂、电极、电解质组成.在结构上与传统电池一样具有正负电极,正负电极被电解质分隔.它以还原剂(用氢作燃料,也可以添加一个氢气变换器,直接使用甲醇、天然气、甚至石油、柴油、煤等作燃料)为负极反应物,以氧化剂(如氧气、空气等)为正极反应物.为了使燃料便于进行电极反应.要求电极材料兼有催化剂的特性.可用多孔碳多孔镍、铂、钯等贵金属以及聚四氟乙烯等电极材料.电解质则有碱性、酸性、熔融盐和固体电解质及高聚物质子交换膜等数种.
如下图所示是一种氢——氧燃料电池的工作原理图,其电解质为有机高分子聚合物:
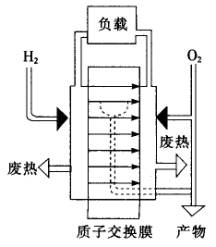
(1)燃料电池中质子交换膜的作用是________________________.
(2)写出氢氧燃料电池正负极发生的电极反应式(注明是氧化反应还是还原反应)和电池的总反应方程式___________________________.
(3)若用燃料电池发电,输出电流的电流强度为533 A,则每小时能合成多少水?
(4)电池燃料氢可利用甲醇、天然气、石油、柴油等,通过一个氢气变换器而得到.写出利用天然气转化为氢气的化学方程式___________________.
(5)请根据文中质子交换膜燃料电池工作原理图,说明负载的电流方向为__________________.
(6)用某种燃料电池给电炉供电,设电炉的额定功率P0=400 W,电池在不接负载时的路端电压与电炉的额定电压相同,当电炉接到该电源上时,电炉实际消耗的功率P1=324W.若两个这样的炉并联接到该电源上,求两个电炉实际消耗的总功率P2为多少?
科目:gzhx 来源: 题型:阅读理解
| 有关物质的物质的量/mol | n(NO) | n(H2O) |
| 温度T1 | 1.6 | 2.4 |
| 温度T2 | 1.2 | 1.8 |
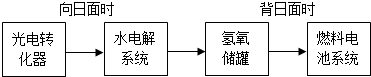
科目:gzhx 来源: 题型:阅读理解
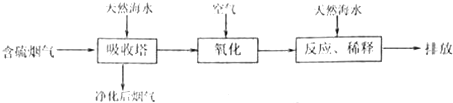
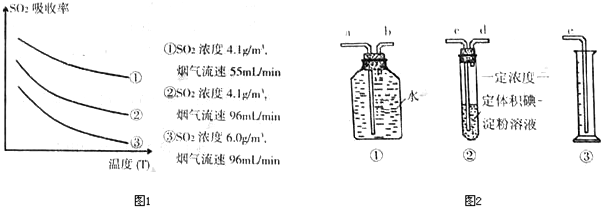
科目:gzhx 来源: 题型:
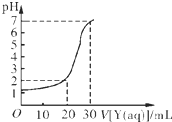 某学生用NaOH标准溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用NaOH标准溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:| A | B | C | D | |
| X/mol•L-1 | 0.09 | 0.03 | 0.9 | 0.3 |
| Y/mol•L-1 | 0.03 | 0.09 | 0.3 | 0.9 |
科目:gzhx 来源:2013届河北保定唐县一中高三下第二次摸底考试化学试卷(带解析) 题型:单选题
向某溶液中逐滴加入0.5mol/L的NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积之间的关系如下图所示 ,则该溶液中可能存在的离子是 
| A.只有Mg2+ | B.只有Al3+ |
| C.有H+、Mg2+和Al3+ | D.有Mg2+和Al3+ |
科目:gzhx 来源:2011-2012学年山东省高三上学期第二次定时练习化学试卷 题型:选择题
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体)。向另一份中逐渐中加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果不正确的是( )
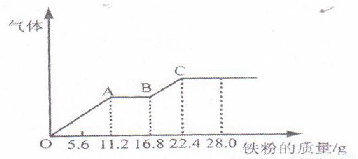
A.原混合酸中NO3-物质的量为0.2mol
B.OA段产生的NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.H2SO4浓度为5 mol·L-1
科目:gzhx 来源:2012年鲁科版高中化学选修3 3.3原子晶体与分子晶体练习卷(解析版 题型:选择题
纳米材料的表面微粒数占总微粒数的比例极大,这是它具有许多特殊性质的原因。假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状(如下图所示)相同,则这种纳米颗粒的表面微粒数占总微粒数的百分数为 ( )
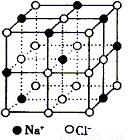
A.87.5% B.92.9% C.96.3% D.100%
科目:gzhx 来源:2013届四川省成都市高二5月月考化学试卷(解析版) 题型:填空题
(12分)工业上一般可采用如下反应来合成甲醇:
CO(g)+2H2(g)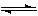 CH3OH(g)
ΔH =-a
kJ·mol-1
CH3OH(g)
ΔH =-a
kJ·mol-1
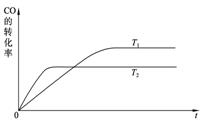
(1)上图是该反应在不同温度下CO的转化率随时间变化的曲线。
① a __0(填“>” “<” “=”)。
② 下列说法正确的是_ _(填序号)。
a.1 mol CO(g) 和2 mol H2(g) 所具有的能量小于1 mol CH3OH(g) 所具有的能量
b.将1 mol CO(g) 和2 mol H2(g) 置于一密闭容器中充分反应后放出a KJ的热量
c.升高温度,平衡向逆反应移动,上述热化学方程式中的a值将减小
d.如将一定量CO(g) 和H2(g) 置于某密闭容器中充分反应后放热a KJ,则此过程中有1 mol CO(g) 被还原
(2)在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如下图所示:
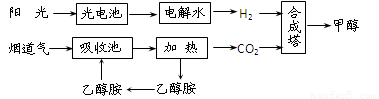
① 该合成路线对于环境保护的价值在于_ _。
② 15%~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2
吸收剂。用离子方程式表示乙醇胺水溶液呈弱碱性的原因:
。
(3)甲醇燃料电池的工作原理如下左图所示。该电池工作时,c口通入的物质发生的电极
反应式为:_ _。
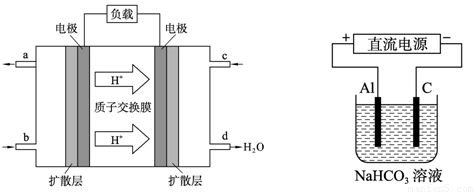
(4)以上述电池做电源,用上右图所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示):
_ 。
科目:gzhx 来源: 题型:
(2)某元素X的核外电子数等于核内中子数,取该元素单质
(3)短周期元素X、Y、Z在周期表中的位置关系如下图所示,则:

①Y、Z元素的气态氢化物的稳定性_______________>_______________。(填化学式)
②与Y元素同主族且相邻的元素的单质与NaOH溶液反应的离子方程式为______________。
科目:gzhx 来源:2010-2011学年黑龙江省高三上学期期末考试化学试卷 题型:填空题
(12分)短周期元素形成的纯净物A、B、C、D、E是转化关系如下图所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同)。
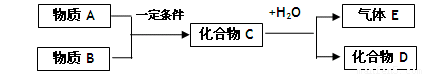
请回答下列问题:
(1)若C是离子化合物,D是一种强碱,写出C的一种化学式 。
(2)若E的水溶液呈现弱酸性,D是既能溶于强酸、又能溶于强碱的化合物。
①用电离方程式解释D既能溶于强酸,又能溶于强碱的原因。
。
②用等式表示E与NaOH溶液反应后生成正盐的溶液中所有离子浓度之间的关系
。
(3)若C是一种气体,D是一种强酸,则:
①C与水反应的化学方程式为 。
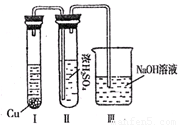
②有人认为“浓H2SO4可以干燥气体C”。某同学为了验证该观点是否正确,用下图装置进行实验。实验过程中,浓H2SO4中未发现有气体逸出,且变为红棕色,则你得出的结论是 。
③已知常温下物质A与物质B生成1mol气体C的△H为-57.07kJ·mol-1,1 mol气体C与H2O反应生成D溶液和E气体的△H为-46kJ ·mol-1,写出物质A与物质B及水生成D溶液的热化学方程式 。
科目:gzhx 来源:2015届安徽省高一下第二次(5月)质量检测化学卷(解析版) 题型:填空题
某可逆反应从0—2分钟进行过程中, 在不同反应时间各物质的量的变化情况如下图所示。

(1)则该反应的化学方程式为 ;
(2)反应开始至2分钟时,能否用C表示反应速率? (填能或不能).若能,其反应速率为 _____ ;若不能,则其原因为 _________ ;
(3)2分钟后A、B、C各物质的量不再随时间的变化而变化,则此时v正(B)与v逆(C)的等量关系是 。
科目:gzhx 来源: 题型:
(15分)短周期常见元素形成的纯净物A、B、C、D、E转化关系如下图所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同)。
请回答下列问题:
(1)若A为金属,C是离子化合物,D是一种强碱,写出A的离子结构示意图 。C的化学式 。D与等物质的量醋酸反应所得溶液的PH____________7,(填﹥,﹤,=)。原因是(用文字和离子方程式说明) 。
(2)若C是一种气体,D是一种强酸,则:
①C与水反应的化学方程式为 。
②有人认为“浓H2SO4可以干燥气体C”。某同学为了验证该观点是否正确,用下图装置进行实验。实验过程中,浓H2SO4中未发现有气体逸出,且变为红棕色,则你得出的结论是 。
③已知常温下1 mol气体C与H2O反应生成D溶液和E气体放出46kJ热量,写出气体C与H2O反应生成D溶液和E气体的热化学方程式 。
科目:gzhx 来源:2013-2014学年江苏省南通市高三第一次调研测试化学试卷(解析版) 题型:实验题
硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用。
(1)已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)=BaS(s)+4CO(g) △H= + 571.2 kJ・mol—1
BaS(s)= Ba(s)+S(s) △H= +460 kJ・mol—1
已知:2C(s)+O2(g)=2CO(g) △H= -221 kJ・mol—1
则:Ba(s)+S(s)+2O2(g)=BaSO4(s) △H= 。
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:
As2S3+10H++ 10NO3-=2H3AsO4+3S+10NO2↑+ 2H2O
当反应中转移电子的数目为2mol时,生成H3AsO4的物质的量为 。
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中主要含硫各物种(H2S、HS—、S2—)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
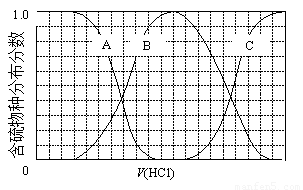
①含硫物种B表示 。在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为 (填字母)。
a.c(Na+)= c(H2S)+c(HS—)+2c(S2—)
b.2c(Na+)=c(H2S)+c(HS—)+c(S2—)
c.c(Na+)=3[c(H2S)+c(HS—)+c(S2—)]
②NaHS溶液呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是 (用离子方程式表示)。
(4)硫的有机物( )与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。
)与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。
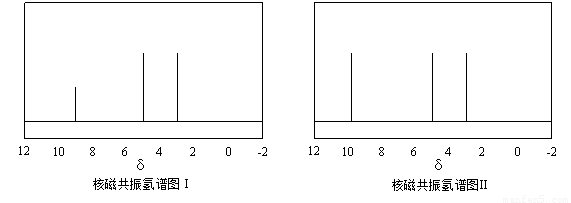
 及X的核磁共振氢谱如下图,其中 (填“Ⅰ”或“Ⅱ”)为
及X的核磁共振氢谱如下图,其中 (填“Ⅰ”或“Ⅱ”)为 的核磁共振氢谱图。写出X的结构简式: 。
的核磁共振氢谱图。写出X的结构简式: 。
科目:gzhx 来源:2011-2012学年广东始兴县风度中学高一下学期期中考试理综化学试卷(带解析) 题型:实验题
(14分)如下图所示,某气体X可能由H2、CO、CH4中的一种或几种组成。将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶。试回答下列问题:
(1) 若A洗气瓶的质量增加,B洗气瓶的质量不变,则气体X是_______________。
(2) 若A洗气瓶的质量不变,B洗气瓶的质量增加,则气体X是______________。
(3) 若A、B两个洗气瓶的质量都增加,则气体X可能是(可以不填满)
| ① | ② | ③ | ④ | ⑤ |
| | | | | |
科目:gzhx 来源:2011届浙江省嘉兴一中高三高考模拟试题(理综)化学部分 题型:单选题
(I)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作冷剂已成为一种趋势,这一做法对环境的积极意义在于 。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a. 6CO2+6H2O C6H12O6+6O2
C6H12O6+6O2
b.CO2+3H2 CH3OH+H2O
CH3OH+H2O
c.CO2+CH4 CH3COOH
CH3COOH
d.2CO2+6H2 CH2=CH2+4H2O
CH2=CH2+4H2O
以上反应中,最节能的是 ,原子利用率最高的是 。
(3)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:
在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g)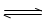 CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CH3OH(g)+H2O(g)△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。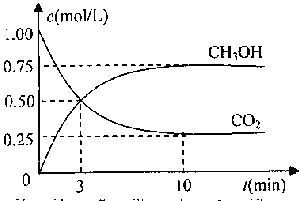
①从反应开始到平衡,氢气的平均反应速率v(H2)= 。
②该反应的平衡常数表达式为 ,升高温度,平衡常数的数值将
(填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 .
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1molCO2和3molH2 |
 2NH3(g) △H=-93.4kJ/mol
2NH3(g) △H=-93.4kJ/mol
