
科目:gzhx 来源:浙江省杭州二中2006-2007学年高三化学月考试题 题型:038
| |||||||||||||||
科目:gzhx 来源: 题型:
下图是Ca(OH)2的溶解度曲线示意图。20℃时,取两份等质量的饱和石灰水,一份加少量生石灰,恢复至室温得到溶液①;另一份升温至50℃,得到溶液②。溶液①与溶液②相比,下列说法正确的是( )

A.c(Ca2+):①>②
B.溶解度:①<②
C.Ca(OH)2的质量分数:①<②
D.pH:①=②
科目:gzhx 来源: 题型:
在Ca(OH)2(Ksp=5.5×10-6)、Mg(OH)2(Ksp=1.2×10-11)、AgCl(Ksp=1.56×10-10)三种物质中,下列说法正确的
A.Mg(OH)2的溶解度最小 B.Ca(OH)2的溶解度最小
C.AgCl的溶解度最小 D.同下Ksp越大的溶解度也越大
科目:gzhx 来源:0116 期中题 题型:单选题
科目:gzhx 来源:山东省聊城三中2009-2010学年高二下学期第四次阶段性测试化学试题 题型:022
水的电离平衡曲线如图所示.
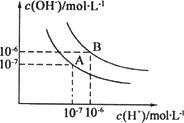
(1)若以A点表示25℃时水的电离平衡的离子浓度,当温度升高到100℃时,水的电离平衡状态移动到B点,则此时水的离子积从________变化到________.
(2)将PH=8的Ba(OH)2溶液与PH=5的稀盐酸混合,并保持100℃的恒温,致使混合溶液的PH=7,则Ba(OH)2和盐酸的体积之比为________.
(3)已知AnBm的离子积为[c(Am+)]·[c(Bn-)]m若某温度下Ca(OH)2的溶解度为0.74 g,设饱和溶液的密度为1 g/mL,其离子积约为________.
(4)已知25℃时,0.1 L 0.1 mol·L-1的NaA溶液的pH=10,则NaA溶液中所存在的离子的物质的量浓度由大到小的顺序为________.
科目:gzhx 来源:2010-2011学年甘肃省张掖中学高一下学期期中考试化学试卷 题型:填空题
(10分)在一支试管中放入几小块镁片,把试管放入盛有25℃的饱和石灰水的烧杯中,用胶头滴管滴5ml盐酸于试管中。试回答下列问题:
(提示:Ca(OH)2的溶解度受随温度的升高而降低。)
⑴该试验中观察到的现象是 ;
⑵产生上述现象的原因是 ;
(3)写出有关反应的离子方程式 ;
⑷在上述试验结束后,将试管取出。在烧杯中放入一个小烧杯,小烧杯中放入氢氧化钡晶体和氯化铵晶体的混合物,用玻璃棒搅拌,则观察到的现象是 ,产生上述现象的原因是 。
科目:gzhx 来源: 题型:
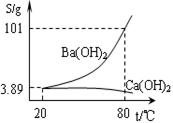
(10分)实验室有一份混有少量碳酸钙杂质的碳酸钡样品。分离并提纯碳酸钡的实验步骤如下,请根据要求填空(下图为Ba(OH)2和Ca(OH)2的溶解度曲线):
(1)高温灼烧碳酸钡和碳酸钙的混合物,直至分解分解。所需仪器除酒精喷灯、泥三角、玻璃棒、三脚架外还有 ;
(2)将灼烧后的固体混合物置于80℃的热水中,制成氢氧化钡的热饱和溶液。为减少Ba(OH)2的损失并除去不溶物应进行的操作是 ;
(3)将“⑵”中滤液 并过滤,得到的Ba(OH)2固体溶于水制成溶液。
(4)向制得的Ba(OH)2溶液中滴加 (填一种试剂名称),再通入二氧化 碳。当观察到 时,即可停止通二氧化碳。
(5)滤出碳酸钡沉淀,经洗涤、干燥后即得到纯净的碳酸钡。
科目:gzhx 来源: 题型:
已知Ca(OH)2的溶解度随温度升高而降低。将某温度下饱和澄清石灰水①加入少量生石灰后恢复到原来温度;②降低温度。这两种情况下,前后均保持不变的是
A.溶液的质量 B.Ca(OH)2的溶解度
C.溶液中Ca2+离子的数目 D.溶液中溶质的质量分数
科目:gzhx 来源: 题型:
实验室有一份混有少量碳酸钙杂质的碳酸钡样品。分离并提纯碳酸钡的实验步骤如下,请根据要求填空(右图为Ba(OH)2和Ca(OH)2的溶解度曲线):![]()
![]()
![]()
![]()
![]()
![]()
![]()
 (1)高温灼烧碳酸钡和碳酸钙的混合物,直至分解分解。
(1)高温灼烧碳酸钡和碳酸钙的混合物,直至分解分解。
所需仪器除坩埚、泥三角、玻璃棒、三脚架外还有
;
(2)将灼烧后的固体混合物置于80℃的热水中,制成氢氧化钡的热饱和溶液。为减少Ba(OH)2的损失并除去不溶物应进行的操作是 ;
(3)将“⑵”中滤液 并过滤,得到的Ba(OH)2固体溶于水制成溶液。
(4)向制得的Ba(OH)2溶液中滴加 (填一种试剂名称),再通入二氧化碳。当观察到 时,即可停止通二氧化碳。
(5)滤出碳酸钡沉淀,经洗涤、干燥后即得到纯净的碳酸钡。
科目:gzhx 来源:09-10年南京六中高二下学期期末考试 题型:填空题
(8分)水的电离平衡曲线如下图所示。

(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)将常温下的pH=8的Ba(OH)2溶液与常温下的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为 。
(3)已知AnBm的离子积=[c(Am+)]n·[c(Bn-)]m,式中c(Am+)n和c(Bn-)m表示离子的物质的量浓度。在某温度下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,其离子积为 。
科目:gzhx 来源:2012届宁夏高二下学期期中考试化学试卷 题型:选择题
常温下Ca(OH)2溶于水达饱和时存在如下平衡: Ca(OH)2(s) Ca(OH)2(aq),Ca(OH)2(aq)
Ca(OH)2(aq),Ca(OH)2(aq) Ca2++2OH— 饱和石灰水的密度为d g/cm3,溶液的pH=12。则该温度下Ca(OH)2的溶解度为
A.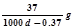 B.
B.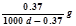 C.
C. D.
D.
科目:gzhx 来源:2012学年山东省潍坊市高二寒假作业化学试卷(五) 题型:填空题
(1)有五瓶溶液分别是①10毫升0.60mol/LNaOH水溶液 ②20毫升0.50mol/L硫酸水溶液 ③30毫升0.40mol/LHCl溶液 ④40毫升0.30mol/LCH3COOH水溶液 ⑤50毫升0.20mol/L蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是__________ _。
(2)水的电离平衡如图所示.

①若A点表示25℃时水的电离平衡状态,当升高温度
至100℃时水的电离平衡状态为B点,则此时水的离子积为 。
②将100℃时pH=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为 。
③已知AnBm的离子积=c(Am+)n•c(Bn-)m,若某温度下Ca(OH)2的溶解度为0.74g,其饱
和溶液的密度为1g/mL,其离子积为 。
(3)现有常温下0.1 mol·L—1的纯碱溶液。
①下列纯碱溶液中离子浓度之间的关系正确的是 。
A.c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-)
B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C.c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.c(CO32-)=c(HCO3-)+c(H2CO3)
②纯碱溶液呈碱性,其原因是(用离子方程式表示) ,
验证纯碱溶液呈碱性的实验方法(简述操作过程): 。
③纯碱溶液与氯化铝溶液混合有大量泡沫生成,其原因是(用离子方程式表示) 。
④某同学认为纯碱溶液中Na2CO3的水解是微弱的,发生水解的CO32-不超过其总量的
10%。请你设计实验证明该同学的观点是否正确。
科目:gzhx 来源:2012-2013吉林省吉林一中高一下学期期中考试化学试卷(带解析) 题型:单选题
下列说法正确的是
| A.在实验室里,可用丁达尔效应区别硫酸钠溶液和淀粉溶液 |
B.由于2NO+2CO 2CO2+N2的ΔH<0,则该反应一定能自发进行 2CO2+N2的ΔH<0,则该反应一定能自发进行 |
| C.给Ca(OH)2溶液加热,则Ca(OH)2的溶解度将增大 |
| D.葡萄糖和蔗糖是同系物,淀粉和纤维素是同分异构体 |
科目:gzhx 来源:2010-2011学年北京市西城区高三上学期期末考试化学试卷 题型:选择题
已知Ca(OH)2的溶解度随温度升高而降低。将某温度下饱和澄清石灰水①加入少量生石灰后恢复到原来温度;②降低温度。这两种情况下,前后均保持不变的是
A.溶液的质量 B.Ca(OH)2的溶解度
C.溶液中Ca2+离子的数目 D.溶液中溶质的质量分数
科目:gzhx 来源:2012-2013吉林省高一下学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.在实验室里,可用丁达尔效应区别硫酸钠溶液和淀粉溶液
B.由于2NO+2CO 2CO2+N2的ΔH<0,则该反应一定能自发进行
2CO2+N2的ΔH<0,则该反应一定能自发进行
C.给Ca(OH)2溶液加热,则Ca(OH)2的溶解度将增大
D.葡萄糖和蔗糖是同系物,淀粉和纤维素是同分异构体
科目:gzhx 来源:2015届湖南省常德市高二上学期第二次检测理科化学试卷(解析版) 题型:选择题
已知Ca(OH)2的溶解度随温度升高而降低。将40℃的饱和澄清石灰水冷却至l0℃,或保持40℃向其中加入少量CaO,两种情况下均保持不变的是
A.溶液中Ca2+的数目
B.溶剂的质量
C.溶液中溶质的物质的量浓度
D.溶质的质量
科目:gzhx 来源: 题型:
将40℃的饱和石灰水冷却至10℃;或加入少量CaO,但温度仍保持40℃,在这两种情况下均未改变的是
A.Ca(OH)2的溶解度、溶剂的质量 B.溶液中溶质的质量分数
C.溶液的质量、水的电离平衡 D.溶液中Ca2+的数目
科目:gzhx 来源:2010年吉林省高二上学期期中考试化学试卷 题型:选择题
将40℃的饱和石灰水冷却至10℃;或加入少量CaO,但温度仍保持40℃,在这两种情况下均未改变的是
A.Ca(OH)2的溶解度、溶剂的质量
B.溶液中溶质的质量分数
C.溶液的质量、水的电离平衡
D.溶液中Ca2+的数目
科目:gzhx 来源: 题型:阅读理解
(12分)某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有能看到浑浊现象。经过思考分析后,该同学改用图二的装置,将气体收集在注射器,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生现象明显比通入CO2快。
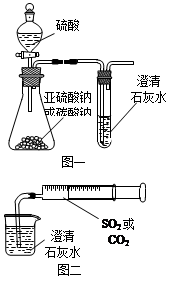
(1)对比分析两组实验,你认为用图一装置实验
时,通入SO2不能出现浑浊的原因可能是:
_________________。
(2)用图二装置实验时,以相同速率通入CO2或
SO2,SO2产生浑浊、澄清的现象比CO2
快的原因是______________________________________。
(3)用图一进行SO2与石灰水反应的实验时,从安全角度
考虑装置应做何改进?
_____________________________________________。
(4)有人提出上述实验现象“石灰水先变浑浊再澄清”可能与澄清石灰水的浓度有关。为了探究CO2通入澄清石灰水中的实验现象,查得下列数据:
Ⅰ 20℃时,Ca(OH)2 的溶解度为:0.165g/100g水。
Ⅱ 不同浓度石灰水生成CaCO3的最大量
| 饱和石灰水与水的体积比 | 1:0 | 1:1 | 1:2 | 1:3 | 1:5 | 1:7 |
| 能生成CaCO3的最大量(g/100水) | A | 0.110 | 0.073 | 0.055 | 0.037 | 0.028 |
① 上表中A= g/100g水
Ⅲ 在1.01×105Pa CO2压力下,CaCO3的溶解度
| 热力学温度/K | 282 | 298 | 308 |
| CaCO3溶解度(g/100水) | 0.130 | 0.094 | 0.076 5 |
Ⅳ 在不同压强(CO2)下,CaCO3溶解度(18℃)
| P(CO2)/Pa | 0 | 1.40×104 | 9.95×104 |
| CaCO3溶解度(g/100水) | 0.001 3 | 0.023 3 | 0.108 6 |
认真分析以上数据回答下列问题:
②由表Ⅲ和表Ⅳ可知CaCO3溶解度的变化规律是:
③由以上数据可以得出结论:欲观察到“石灰水先变浑浊再澄清的现象”,所需要的实验条件是:
科目:gzhx 来源:2013届河北广平县第一中学高二第二次调研考试理科化学试题(解析版) 题型:选择题
将40℃的饱和石灰水冷却至10℃;或加入少量CaO,但温度仍保持40℃,在这两种情况下均未改变的是
A、Ca(OH)2的溶解度、溶剂的质量 B、溶液中溶质的质量分数
C、溶液的质量、水的电离平衡常数 D、溶液中Ca2+的数目