
科目:gzhx 来源: 题型:
| 120 |
| 6-a |
| 36a-96 |
| 6-a |
| 36a-96 |
| 6-a |
| 0.07 |
| a |
| 0.07 |
| a |
科目:gzhx 来源: 题型:解答题
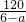 ,则XeO3的系数为______(用a表示).
,则XeO3的系数为______(用a表示).科目:gzhx 来源:祁东县鼎兴补习学校2010届高三化学第一次月考化学试题卷 题型:013
|
BrF3+H2O-Br2+HBrO3+O2↑+HF(未配平)化学反应中,若有10.8 g水被氧化,则被水还原的BrF3的物质的量是 | |
| [ ] | |
A. |
0.4 mol |
B. |
0.6 mol |
C. |
0.8 mol |
D. |
0.9 mol |
科目:gzhx 来源: 题型:
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
科目:gzhx 来源: 题型:阅读理解

| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
| KOHg/100g水 | 49.2 | 50.8 | 52.8 | 59.8 | 62.4 | 78.6 |
科目:gzhx 来源: 题型:阅读理解
 得到碘酸钾晶体,你建议的方法是
得到碘酸钾晶体,你建议的方法是| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
科目:gzhx 来源:2010-2011学年西藏拉萨中学高三第六次月考(理综)化学部分 题型:填空题
我国中医药已有数千年历史,其独特的疗效使得经深加工的中药产品正逐步进入国际市场,但国外在进口中药时对中药的重金属元素和有毒元素的含量等各项指标检查是非常严格的,因此把好出口中药的质量关是非常重要的。以下介绍了分析实验室对中草药中可能的残余有毒元素As的检验方法和步骤(As在中草药中主要以As2O3的形式存在):
①取1000g中草药样品进行前期处理制得待测溶液,此时样品中可能含有的As元素将转化为H3AsO3;
②将待测溶液转移入250mL锥形瓶中,并加入2-3滴0.2%的淀粉溶液;
③用标准碘溶液滴定待测溶液至终点,消耗20.25mL标准I2溶液,其间发生反应:
H3AsO3+ I2+ H2O→H3AsO4+ I-+ H+(未配平)
试回答下列问题:
(1)简述如何对少量的中草药样品进行前期处理制得待测溶液?
。
(2)配平离子反应方程式:__H3AsO3+__I2+__H2O— __H3AsO4+__I-+__H+
(3)0.2%的淀粉溶液的作用是 ,如何判断滴定到达终点? 。
(4)题中所用标准碘溶液并非将碘单质直接溶解于蒸馏水中制得,而是由0.1070g纯KIO3、过量的KI以及酸混合,并将其准确稀释到1000 mL而制得,请用一个离子反应方程式说明标准碘溶液的形成过程 。
(5)我国《药用植物及制剂进出口绿色行业标准》中限定:绿色中药的砷含量不超过2.000mg/kg,试计算说明该中草药样品是否合格?(不需计算过程)计算可知该样品砷含量约为 mg/kg,故该草药样品 (填“合格”或“不合格”)。
科目:gzhx 来源: 题型:
(1)在一定条件下可以进行如下反应:H2O +R2O8n-+Mn2+→MnO4-+RO42- + H+ (未配平),又知该反应中氧化剂与还原剂的物质的量之比为5:2,则R2O8n-中n的值为 。
(2)反应 2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O 可用于实验室制取氯气
①用双线桥表示出该反应的电子转移情况:
2KMnO4 + 16HCl = 2KCl + 2MnCl2+ 5Cl2↑+ 8H2O
②在标准状况下,该反应产生2.24 L Cl2时,消耗氧化剂 mol,被氧化的物质的质量为 g。
科目:gzhx 来源:2010-2011学年海南省海口市高三下学期高考调研测试(二)化学试卷 题型:填空题
(8分)我国对中药中重金属元素和有毒元素的含量等各项指标检查是非常严格的。下面是分析实验室对中草药中可能的残余有毒元素As的检验方法和步骤(As在中草药中主要以As2O3的形式存在):
① 取1000g中草药样品进行前期处理制得待测溶液,此时样品中可能含有的As元素将转化为H3AsO3;
② 将待测溶液转移到250mL锥形瓶中,并加入2-3滴0.2%的淀粉溶液;
③ 用0.001mol/L标准碘溶液滴定待测溶液至终点,消耗20.00mL标准I2溶液,发生的反应为:H3AsO3+ I2+ H2O→H3AsO4+ I-+ H+(未配平)
试回答下列问题:
(1)简述如何对中草药样品进行前期处理制得待测溶液? 。
(2)配平离子反应方程式:__H3AsO3+__I2+__H2O— __H3AsO4+__I-+__H+
(3)如何判断滴定到达终点? 。
(4)我国《药用植物及制剂进出口绿色行业标准》中规定:绿色中药的砷含量不能超过
2.000mg/kg,试计算该草药样品中砷含量为 mg/kg,则该草药样品 (填
“合格”或“不合格”)。
科目:gzhx 来源:2010年重庆一中高一12月月考化学试卷 题型:填空题
(1)在一定条件下可以进行如下反应:H2O +R2O8n-+Mn2+→MnO4-+RO42-+ H+ (未配平),又知该反应中氧化剂与还原剂的物质的量之比为5:2,则R2O8n-中n的值为 。
(2)反应 2KMnO4 + 16HCl =" 2KCl" + 2MnCl2 + 5Cl2↑ + 8H2O 可用于实验室制取氯气
①用双线桥表示出该反应的电子转移情况:
2KMnO4 + 16HCl =" 2KCl" + 2MnCl2+ 5Cl2↑+ 8H2O
②在标准状况下,该反应产生2.24 L Cl2时,消耗氧化剂 mol,被氧化的物质的质量为 g。
科目:gzhx 来源: 题型:
①P+A→Q+B ②L+O2→M+H2O ③L+M→R+H2O ④B+H2O→A+O2
(1)若五种含氮元素的物质中,有一种是硝酸,则硝酸是_________,理由是_________________________________。
(2)反应②必须在催化剂(铂、氧化铁等)作用下,加热到一定温度时方能发生,此反应在化工生产上有重要用途。据此推断在同温同压下,若物质R的密度比二氧化碳的密度小,则R的化学式为__________。
(3)某学生写出下面三个含氮物质的相互转化的关系式:
(a)M+P→N2O3+H2O (b)N2O4+H2O→P+Q (c)M+L→Q+H2O
其中一定不可能实现的是____________,理由是_________________________________。
科目:gzhx 来源: 题型:
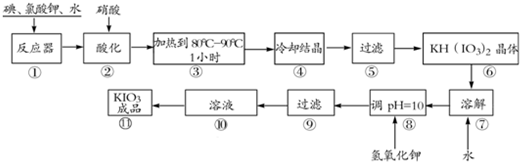
(10分)碘酸钾是一种白色结晶粉末,无臭无味。在酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560 ℃开始分解。工业生产碘酸钾的流程如下图所示。
(1)在反应器中发生的反应I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平),生成两种还原产物所得电子数目相同,请写出已配平的该反应的化学方程式: 。
(2)步骤②中,用硝酸而不用HI,其原因可能是 。
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为 。
(4)参照下表碘酸钾的溶解度,步骤⑾得到碘酸钾晶体,应采用的方法是 。
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3(g/100g水) | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
(5)KIO3可用电解的方法制得,原理是以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液。总反应方程式为KI+3H2O=KIO3+3H2↑,则阴极的电极反应式为 。
科目:gzhx 来源:2010年重庆一中高一12月月考化学试卷 题型:填空题
(1)在一定条件下可以进行如下反应:H2O +R2O8n-+Mn2+→MnO4-+RO42- + H+ (未配平),又知该反应中氧化剂与还原剂的物质的量之比为5:2,则R2O8n-中n的值为 。
(2)反应 2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O 可用于实验室制取氯气
①用双线桥表示出该反应的电子转移情况:
2KMnO4 + 16HCl = 2KCl + 2MnCl2+ 5Cl2↑+ 8H2O
②在标准状况下,该反应产生2.24 L Cl2时,消耗氧化剂 mol,被氧化的物质的质量为 g。
科目:gzhx 来源: 题型:
碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平)
(1)在反应器中发生的反应I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平),生成两种还原产物所得电子数目相同,请写出已配平的该反应的化学方程式: _______________。
若有1 mol I2完全反应,则该反应中转移电子的数目为______(设NA表示阿伏加德罗常数)
(2)步骤②中,用硝酸而不用HI,其原因可能是________________________。
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为________。
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是__________。
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
(5)KIO3可用电解的方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液。总反应方程式为KI+3H2O=KIO3+3H2↑,则阳极的电极反应式为:___________________________。
科目:gzhx 来源: 题型:
(1)在一定条件下可以进行如下反应:H2O+R2O8n-+Mn2+→MnO4-+RO42- + H+ (未配平),又知该反应中氧化剂与还原剂的物质的量之比为5:2,则R2O8n-中n的值为 。
(2)反应 2KMnO4 + 16HCl = 2KCl + 2MnCl2+ 5Cl2↑ + 8H2O 可用于实验室制取氯气
①用双线桥表示出该反应的电子转移情况:
2KMnO4 + 16HCl = 2KCl + 2MnCl2+5Cl2↑+ 8H2O
②在标准状况下,该反应产生2.24 L Cl2时,消耗氧化剂 mol,被氧化的物质的质量为 g。
科目:gzhx 来源:2011-2012学年北京市顺义区高三尖子生综合素质展示化学试卷 题型:实验题
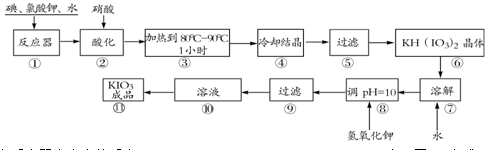
(10分)碘酸钾是一种白色结晶粉末,无臭无味。在酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560 ℃开始分解。工业生产碘酸钾的流程如下图所示。

(1)在反应器中发生的反应I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平),生成两种还原产物所得电子数目相同,请写出已配平的该反应的化学方程式: 。
(2)步骤②中,用硝酸而不用HI,其原因可能是 。
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为 。
(4)参照下表碘酸钾的溶解度,步骤⑾得到碘酸钾晶体,应采用的方法是 。
|
温度/℃ |
0 |
10 |
20 |
40 |
60 |
80 |
|
KIO3(g/100g水) |
4.60 |
6.27 |
8.08 |
12.6 |
18.3 |
24.8 |
(5)KIO3可用电解的方法制得,原理是以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液。总反应方程式为KI+3H2O=KIO3+3H2↑,则阴极的电极反应式为 。
科目:gzhx 来源:2010-2011学年辽宁省锦州市高三检测二(理综)化学部分 题型:填空题
碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平)

(1)在反应器中发生的反应I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平),生成两种还原产物所得电子数目相同,请写出已配平的该反应的化学方程式: _______________。
若有1 mol I2完全反应,则该反应中转移电子的数目为______(设NA表示阿伏加德罗常数)
(2)步骤②中,用硝酸而不用HI,其原因可能是________________________。
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为________。
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是__________。
|
温度/℃ |
0 |
10 |
20 |
40 |
60 |
80 |
|
KIO3g/100g水 |
4.60 |
6.27 |
8.08 |
12.6 |
18.3 |
24.8 |
(5)KIO3可用电解的方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液。总反应方程式为KI+3H2O=KIO3+3H2↑,则阳极的电极反应式为:___________________________。
科目:gzhx 来源: 题型:阅读理解
我国中医药已有数千年历史,其独特的疗效使得经深加工的中药产品正逐步进入国际市场,但国外在进口中药时对中药的重金属元素和有毒元素的含量等各项指标检查是非常严格的,因此把好出口中药的质量关是非常重要的。以下介绍了分析实验室对中草药中可能的残余有毒元素As的检验方法和步骤(As在中草药中主要以As2O3的形式存在):
①取1000g中草药样品进行前期处理制得待测溶液,此时样品中可能含有的As元素将转化为H3AsO3;
②将待测溶液转移入250mL锥形瓶中,并加入2-3滴0.2%的淀粉溶液;
③用标准碘溶液滴定待测溶液至终点,消耗20.25mL标准I2溶液,其间发生反应:
H3AsO3+ I2+ H2O→H3AsO4+ I-+ H+(未配平)
试回答下列问题:
(1)简述如何对少量的中草药样品进行前期处理制得待测溶液?
。
(2)配平离子反应方程式:__H3AsO3+__I2+__H2O— __H3AsO4+__I-+__H+
(3)0.2%的淀粉溶液的作用是 ,如何判断滴定到达终点? 。
(4)题中所用标准碘溶液并非将碘单质直接溶解于蒸馏水中制得,而是由0.1070g纯KIO3、过量的KI以及酸混合,并将其准确稀释到1000 mL而制得,请用一个离子反应方程式说明标准碘溶液的形成过程 。
(5)我国《药用植物及制剂进出口绿色行业标准》中限定:绿色中药的砷含量不超过2.000mg/kg,试计算说明该中草药样品是否合格?(不需计算过程)计算可知该样品砷含量约为 mg/kg,故该草药样品 (填“合格”或“不合格”)。
科目:gzhx 来源: 题型:
L、M、R、P、Q分别代表五种含不同化合价的氮元素的物质,A、B分别代表两种含不同氯元素的物质(每种物质中,氮和氯元素的化合价只有一种);又知M中氮元素的化合价要比Q物质中氮元素的化合价低。在一定条件下,它们会发生如下的转化(未配平):
①P+A→Q+B ②L+O2→M+H2O ③L+M→R+H2O ④B+H2O→A+O2
(1)若五种含氮元素的物质中,有一种是硝酸,则硝酸是_______________________,理由是_____________________________________________________________________________。
(2)反应②必须在催化剂(铂、氧化铁等)作用下,加热到一定温度时方能发生,此反应在化工生产上有重要用途。据此推断在同温同压下,若物质R的密度比二氧化碳的密度小,则R的化学式为___________________________________________________________________。
(3)某学生写出下面三个含氮物质的相互转化的关系式:
(a)M+P→N2O3+H2O (b)N2O4+H2O→P+Q (c)M+L→Q+H2O
其中一定不可能实现的是____________,理由是____________________________________
______________________________________________________________________________。
科目:gzhx 来源:2012届北京市顺义区高三尖子生综合素质展示化学试卷 题型:实验题
(10分)碘酸钾是一种白色结晶粉末,无臭无味。在酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560 ℃开始分解。工业生产碘酸钾的流程如下图所示。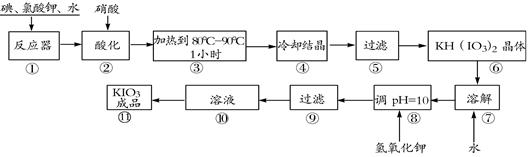
(1)在反应器中发生的反应I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平),生成两种还原产物所得电子数目相同,请写出已配平的该反应的化学方程式: 。
(2)步骤②中,用硝酸而不用HI,其原因可能是 。
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为 。
(4)参照下表碘酸钾的溶解度,步骤⑾得到碘酸钾晶体,应采用的方法是 。
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3(g/100g水) | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |