
题目列表(包括答案和解析)
氢化钙(CaH2)是一种常用的储氢材料,某化学兴趣小组通过查阅资料并在老师的指导下设计了制取氢化钙并测定制取的氢化钙样品中氢化钙的质量分数。
【资料在线】
Ⅰ.用氢气与金属钙加热的方法可制得氢化钙。
Ⅱ.氢化钙要密封保存,一旦接触到水就发生反应,放出氢气,并生成一种碱。
Ⅲ.金属钙的活动性很强,遇水即刻剧烈反应生成氢氧化钙,同时产生一种气体。
【探究一:氢化钙的制取及定性分析】
(1)写出用氢气与金属钙加热制取氢化钙的化学方程式 。
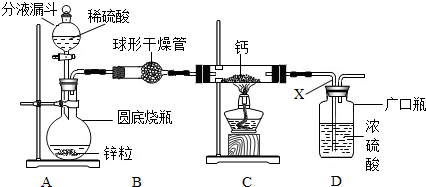
(2)下图该化学兴趣小组设计的用氢气与金属钙加热制取氢化钙的实验装置。
 |
①利用该装置进行实验,步骤如下:检查装置气密性后,装入药品,打开分液漏斗活塞,
请按正确的顺序填入下列步骤的序号 。
A.关闭分液漏斗活塞
B.点燃酒精灯,加热反应一段时间
C.收集气体并检验其纯度
D.停止加热,充分冷却
②检查整套装置气密性的方法是:连接好装置,关闭A中分液漏斗活塞,在D中放适量的水![]() 浸没 x 导管口,用酒精灯微热圆底烧瓶,若D中 x 导管口有气泡冒出,停止微热至冷却 后 x 导管中 ,说明装置不漏气。
浸没 x 导管口,用酒精灯微热圆底烧瓶,若D中 x 导管口有气泡冒出,停止微热至冷却 后 x 导管中 ,说明装置不漏气。
(3)制备氢化钙实验结束后,某同学取少量产物,小心![]() 加入水中,观察到有气泡冒出, 在溶液中滴入酚酞后显 色。
加入水中,观察到有气泡冒出, 在溶液中滴入酚酞后显 色。
该同学据此判断:上述实验确有C![]() aH2生成。你认为是否正确 (填“是”或“否”); 原因是 。
aH2生成。你认为是否正确 (填“是”或“否”); 原因是 。
【探究二:产物定量测定】
测定原理:
 |
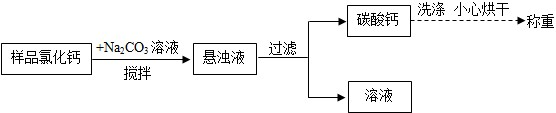
称取上述制得的氢化钙样品(假设不含其他杂质)1.0 g加入足量的碳酸钠溶液,充分搅拌后、过滤、洗涤、干燥,称量碳酸钙质量2.4 g, 求样品中钙元素和氢元素的质量比(列 出计算过程)。
结论:该样品中氢化钙的质量分数是
| ||
| ||
(6分)水和溶液在生产生活中起着重要的作用。
(1)氢气燃烧是人们认识水组成的开始,该反应的化学方程式为 。
(2)下列实验中,水用来隔绝空气的是 (填字母序号)。

A.溶解物质 B.铁丝燃烧 C.水的电解 D.保存白磷
(3)为检测饮用水是否为硬水,可向所取水样及另一软水中加入等量的 来判断。生活中将硬水软化的方法是 ,此过程产生水垢,其成分是CaCO3和Mg(OH)2。实验室从该水垢中提取氯化钙晶体的主要流程如下:

向滤液中加入盐酸的目的是 (用化学方程式解释)。
(4)20 ℃时,取甲、乙、丙、丁四种物质各20 g,分别加入到四个盛有50 g水的烧杯中,
充分溶解,情况如下表(温度保持20 ℃),下列说法正确的是 (填字母序号)。
物质 | 甲 | 乙 | 丙 | 丁 |
未溶解固体的质量 /g | 4.2 | 2 | 0 | 9.2 |
A.所得溶液一定都是饱和溶液
B.溶质质量分数最大的是丙溶液
C.所得四种溶液的质量关系为:丙>乙>甲>丁
D.20 ℃时四种物质溶解度的关系为:丙>乙>甲>丁
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com