
题目列表(包括答案和解析)
(1)N2(1分) 50%(1分) 、
(2)解:设理论上需要氨气的质量为x
5CH3OH+12O2+6NH3========3B+5CO2+19H2O
5×32 6×17
500t×0.32% x …………………………………………………………(1分)
x=1.02t…………………………(1分)
解: (1)0.48g
(2)解:设5 1g过氧化氢溶液中含过氧化氢的质量为x。
2H2O2![]() 2H2O + O2↑
2H2O + O2↑
68 32
x 0.48g
![]()
![]()
![]() 过氧化氢溶液中溶质的质量分数为
过氧化氢溶液中溶质的质量分数为
| ||

| ||
| ||
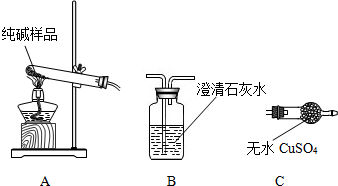
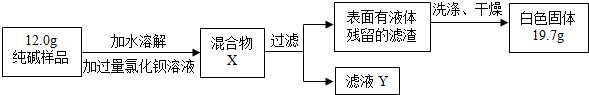
| 选择的装置 | 实验现象 | 实验结论 |
AB”或“AC”或“ACB AB”或“AC”或“ACB |
“B不变浑浊”或“C不变蓝”或“C不变蓝、B不变浑” “B不变浑浊”或“C不变蓝”或“C不变蓝、B不变浑” |
样品不含晶体A |
| 106 |
| X |
| 197 |
| 19.7g |
| 10.6g |
| 12.0g |
| 106 |
| X |
| 197 |
| 19.7g |
| 10.6g |
| 12.0g |
分析:首先搞清:①石灰石的主要成分是CaCO3;②混合物减少的质量即CaCO3跟盐酸反应,生成CO2的质量;③根据化学方程式中CaCO3与盐酸、CO2的质量关系可计算出CaCO3的质量和用去盐酸的质量,再根据密度即可求出盐酸的体积。
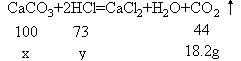 解:设参加反应的CaCO3的质量为xg,盐酸溶液中的溶质质量为y。
解:设参加反应的CaCO3的质量为xg,盐酸溶液中的溶质质量为y。
100∶44=x∶18.2g x=41.4g
 73∶44 = y∶18.2g y=30.2g
73∶44 = y∶18.2g y=30.2g
消耗盐酸=30.2g÷20%=151g
20%盐酸的体积=151/1.10=137.3(mL)答:略。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com