
题目列表(包括答案和解析)
亚铁是血红蛋白的重要组成成分,起着向人体组织传送O2 的作用,若缺铁就可能出现缺铁性贫血。下面是一种常见补铁药品说明书中的部分内容:该药品含Fe2+ 33%—36%,不溶于水但能溶于人体中的胃酸;与Vc(维生素C)同服可增加本品吸收。
Ⅰ.甲同学设计了以下实验检测该补铁药品中是否含有Fe2+并探究Vc的作用:
![]()
⑴加入新制氯水后溶液中发生的离子反应方程式是_____________、 。
⑵加入KSCN后溶液变淡红色,说明溶液中有少量Fe3+。该离子存在的可能原因___________。
A.药品中的铁本来就应该以三价铁的形式存在
B.在实验过程中有少量二价铁被氧化 C.药品储存过程中有少量三价铁生成
⑶向血红色溶液中加入一片Vc片,片刻后溶液血红色褪去,说明Vc有 性。
Ⅱ.乙同学采用酸性高锰酸钾标准液滴定法测定该药品是否合格,原理:5Fe2++8H++MnO4-=5Fe3++2Mn2++4H2O 。准确称量上述药品10.00g,将其全部溶于试剂2,配成1000mL溶液,取出20.00mL,用0.0200 mol·L-1的KMnO4 溶液滴定,用去KMnO4溶液12.00 mL.
⑷该实验中的试剂2与甲同学设计实验中的试剂1都可以是 (填编号)。
A.蒸馏水 B.稀盐酸 C.稀硫酸 D.稀硝酸
⑸本实验滴定过程中操作滴定管的图示正确的是 (填编号)。
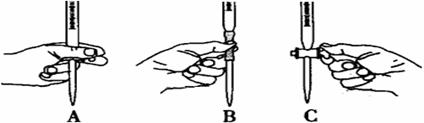
⑹判断实验到达滴定终点的现象为 。
(7)经计算该药品中铁元素的百分含量为 。
某氯化亚铁和氯化铁的混合物。现要测定其中铁元素的质量分数,进行如下实验:
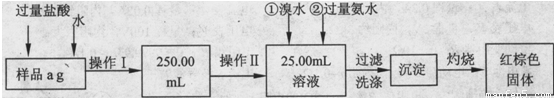
Ⅰ.甲同学根据如下流程进行实验,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 (填仪器名称)
(2)请写出加入溴水发生的离子反应方程式 。
(3)将沉淀物置于坩埚中加热至恒重后,冷却至室温,称量剩余固体和坩埚的质量,计算。
实验中加热至恒重的目的是 。
(4)若坩埚质量是W1g,坩埚与加热后固体总质量是W2g,则样品中铁元素的质量分数是 。
Ⅱ.乙同学提出,还可以采用以下方法来测定:
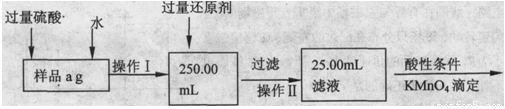
(1)溶解样品改用了硫酸,用离子方程式指明不再用盐酸原因是 ;
(2)若要用实验证明操作Ⅱ所得滤液中不存在Fe3+,其最可靠的化学方法是 ;
(3)若滴定用掉c mol/L KMn04溶液b mL,则样品中铁元素的质量分数是 。
某氯化亚铁和氯化铁的混合物。现要测定其中铁元素的质量分数,按以下步骤进行实验:
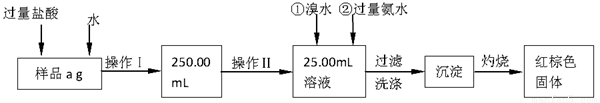
Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 。(填仪器名称)
(2)请写出加入溴水发生的离子反应方程式 。
(3)将沉淀物加热、灼烧,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是 ;蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是 。
Ⅱ.有同学提出,还可以采用以下方法来测定:
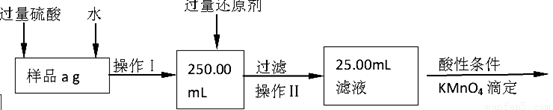
(1)溶解样品改用了硫酸,而不再用盐酸,为什么 ;
(2)选择的还原剂是否能用铁 (填“是”或“否”),原因是:
;
(3)若滴定用掉c mol•L-1 KMnO4溶液b mL,则样品中铁元素的质量分数是: 。
某氯化亚铁和氯化铁的混合物。现要测定其中铁元素的质量分数,进行如下实验:
Ⅰ.甲同学根据如下流程进行实验,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 (填仪器名称)
(2)请写出加入溴水发生的离子反应方程式 。
(3)将沉淀物置于坩埚中加热至恒重后,冷却至室温,称量剩余固体和坩埚的质量,计算。
实验中加热至恒重的目的是 。
(4)若坩埚质量是W1g,坩埚与加热后固体总质量是W2g,则样品中铁元素的质量分数是 。
Ⅱ.乙同学提出,还可以采用以下方法来测定: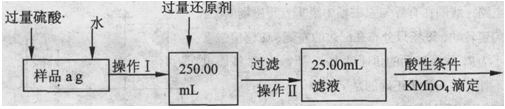
(1)溶解样品改用了硫酸,用离子方程式指明不再用盐酸原因是 ;
(2)若要用实验证明操作Ⅱ所得滤液中不存在Fe3+,其最可靠的化学方法是 ;
(3)若滴定用掉c mol/L KMn04溶液b mL,则样品中铁元素的质量分数是 。
某氯化亚铁和氯化铁的混合物。现要测定其中铁元素的质量分数,按以下步骤进行实验: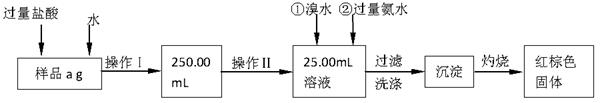
Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 。(填仪器名称)
(2)请写出加入溴水发生的离子反应方程式 。
(3)将沉淀物加热、灼烧,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是 ;蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是 。
Ⅱ.有同学提出,还可以采用以下方法来测定: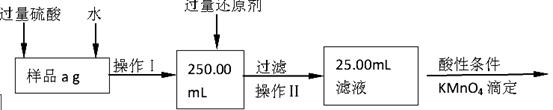
(1)溶解样品改用了硫酸,而不再用盐酸,为什么 ;
(2)选择的还原剂是否能用铁 (填“是”或“否”),原因是:
;
(3)若滴定用掉c mol?L-1 KMnO4溶液b mL,则样品中铁元素的质量分数是: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com