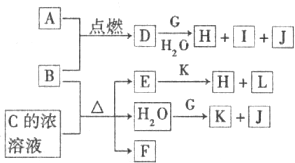
(2012?唐山二模)图中,A~L为常见物质或该物质的水溶液,B在A气体中燃烧产生棕黄色烟,B、G为中学化学中常见的金属单质,E的稀溶液为蓝色,I的焰色反应为黄色,组成J的元素原子核内只有一个质子,F为无色、有刺激性气味的气体,且能使品红溶液褪色.
回答下列问题:
(1)A元素在周期表中的位置是
第3周期ⅦA族
第3周期ⅦA族
(填所在周期和族),K固体中所含的化学键有
离子键和共价键(或极性共价键)
离子键和共价键(或极性共价键)
.
(2)①D的水溶液与G反应的离子方程式为
Cu2++2H2O+2Na═Cu(OH)2↓+2Na++H2↑
Cu2++2H2O+2Na═Cu(OH)2↓+2Na++H2↑
.
②A和K是重要的化工原料,工业上同时制取A单质和K的反应的化学方程式为
.
(3)若将标准状况下2.24L的F通入150mL 1.0m1?L
-1的K溶液中,充分反应后,测得溶液显酸性,所得溶质及其物质的量分别为
Na2SO3为0.05mol,NaHSO3为0.05mol
Na2SO3为0.05mol,NaHSO3为0.05mol
.
(4)与F组成元素相同的一种-2价酸根离子M,M中两种元素的质量比为4:3,已知1mol A单质与含1mol M的溶液能恰好完全反应,反应时仅观察到有浅黄色沉淀产生.取反应后的上层清液加入盐酸酸化的氯化钡溶液,有白色沉淀产生.则A单质与含M的溶液反应的离子方程式为
Cl2+S2O32-+H2O═2Cl-+2H++S↓+SO42-
Cl2+S2O32-+H2O═2Cl-+2H++S↓+SO42-
.


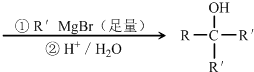




 +2NaOH
+2NaOH
 +NaBr+2H2O
+NaBr+2H2O +2NaOH
+2NaOH
 +NaBr+2H2O
+NaBr+2H2O


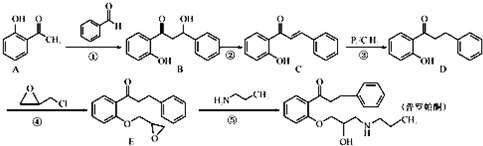
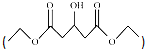 是一种医药中间体,请结合流程信息,写出以丙酮、乙醇和甲醛为原料,制备该化合物的合成路线流程图(无机试剂任用)
是一种医药中间体,请结合流程信息,写出以丙酮、乙醇和甲醛为原料,制备该化合物的合成路线流程图(无机试剂任用)