
(2010?宝鸡三模)[化学-选修3物质结构与性质]
现有A、B、C、D、E、F、G七种原子序数小于36的元素,其原子序数的依次增大,其中A、B、C、D、E为短周期元素.
已知:①A、C两元素的基态原子中P能级上均有2个未成对电子;
②D是短周期中电负性最小的元素;
③E是一种非金属元素,其基态原子中P能级上有1个未成对电子;
④元素F与元素D同族;
⑤元素G的基态原子中d能级上有3个空轨道.
请回答下列问题:
(1)元素B与元素C的第一电离能大小比较为
N
N
>
O
O
(填元素符号),元素B与元素C对应氢化物的稳定性大小比较为
H2O
H2O
>
NH3
NH3
(填分子式).
(2)元素A与元素E形成的分子中各原子最外层均达到了8电子结构,该分子里的中心 原子的杂化轨道类型为
sp3
sp3
,分子中相邻化学键之间的夹角为
109°28′
109°28′
.
(3)元素D与元素F分别与元素E形成的晶体熔点高低的比较为
NaCl
NaCl
>
KCl
KCl
(填化学式),原因为
NaCl晶体的晶格能大于KCl晶体的晶格能
NaCl晶体的晶格能大于KCl晶体的晶格能
.
(4)元素G的基态原子的核外电子排布式为
1s22s22p63s23p63d24s2
1s22s22p63s23p63d24s2
.
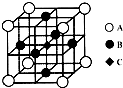
(5)由元素G与元素C组成的一种矿石叫金红石,其晶体的一个晶胞结构如右图所示,则可推知金红石的化学式为
TiO2
TiO2
.

 (2013?南通一模)【物质结构与性质】
(2013?南通一模)【物质结构与性质】



 (2012?许昌三模)[化学--选修3:物质结构与性质]砷(As)是一种重要的化学元素,其可形成多种用途广泛的化合物.
(2012?许昌三模)[化学--选修3:物质结构与性质]砷(As)是一种重要的化学元素,其可形成多种用途广泛的化合物. (2010?宝鸡三模)[化学-选修3物质结构与性质]
(2010?宝鸡三模)[化学-选修3物质结构与性质]