
题目列表(包括答案和解析)
 (2009?南京二模)工业上可利用合成气(CO和H2的混合气体)生产甲醇(如反应④).已知:
(2009?南京二模)工业上可利用合成气(CO和H2的混合气体)生产甲醇(如反应④).已知:| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 组别 | 原料气中各组分的体积分数 | |||
| CO | CO2 | H2 | N2 | |
| 第1组 | 19.7 | 0.0 | 59.1 | 21.2 |
| 第2组 | 20.7 | 0.3 | 62.1 | 16.9 |
| 第3组 | 16.9 | 1.3 | 50.7 | 31.1 |
| 第4组 | 19.8 | 5.5 | 59.4 | 15.3 |
| 第5组 | 20.3 | 10.9 | 60.9 | 7.9 |
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 组别 | 原料气中各组分的体积分数 | |||
| CO | CO2 | H2 | N2 | |
| 第1组 | 19.7 | 0.0 | 59.1 | 21.2 |
| 第2组 | 20.7 | 0.3 | 62.1 | 16.9 |
| 第3组 | 16.9 | 1.3 | 50.7 | 31.1 |
| 第4组 | 19.8 | 5.5 | 59.4 | 15.3 |
| 第5组 | 20.3 | 10.9 | 60.9 | 7.9 |
(16分)甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上常用CO和H2反应生产CH3OH,并开发出甲醇燃料电池。
(1)已知:CO(g)+1/2O2(g)=CO2(g) △H=-283.0 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1453.0 kJ·mol-1
则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为 。
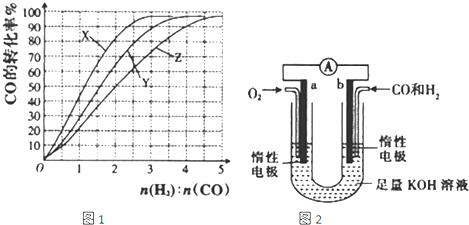
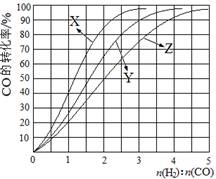
(2)工业上常利用反应CO(g)+2H2(g)≒CH3OH(g) △H<0合成甲醇,在230℃~270℃最为有利。为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图。
|
A.1~1.5 B.2.5~3 C.3.5~4.5
(3)制甲醇所需要的氢气,可用下列反应制取:H2O(g)+CO(g) H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
①该温度下,若起始时c(CO)=1 mol·L-1,c(H2O)=2 mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应v(正) v(逆)(填“>”、“<”或“=”)。
②若降低温度,该反应的K值将 (填“增大”、“减 小”或“不变”)。
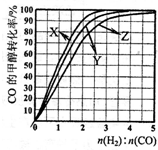
(4)某实验小组设计了如图所示的甲醇燃料电池装置。
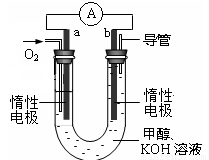
①该电池工作时,OH-向 极移动(填“a”或“b”)。
②工作一段时间后,测得溶液的pH减小,该电池负极反应式为 , 电池总反应的离子方程式为 。
 CH3OH(g) △H<0合成甲醇,在230℃~270℃最为有利。为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图
CH3OH(g) △H<0合成甲醇,在230℃~270℃最为有利。为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图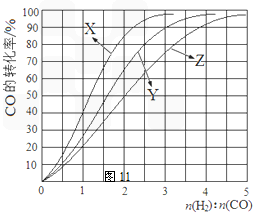
 H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题: 
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com