某学习小组按如图在实验室制取氨气并探究铜的有关性质(部分夹持仪器未画出).
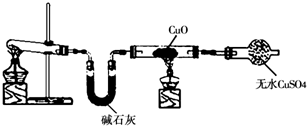
请回答:
(1)制取氨气的化学方程式是
Ca(OH)
2+2NH
4Cl
CaCl
2+2H
2O+2NH
3↑
Ca(OH)
2+2NH
4Cl
CaCl
2+2H
2O+2NH
3↑
.
(2)①实验现象为:黑色CuO变为红色(生成单质a);白色无水CuSO
4粉末变为蓝色; 同时生成一种无色气体,该气体无污染.请写出氨气与CuO反应的化学方程式
.②碱石灰的作用是
吸收氨气中混有的水蒸气,防止干扰产物的鉴定
吸收氨气中混有的水蒸气,防止干扰产物的鉴定
.
(3)将上述生成的单质a在热水浴中进行4个实验,部分实验报告如下表所示.
| 序号 |
实验操作 |
实验现象 |
| Ⅰ |
稀硫酸中加入该单质a |
无明显变化 |
| Ⅱ |
硝酸钠溶液中加入该单质a |
无明显变化 |
| Ⅲ |
硫酸钠溶液中加入该单质a |
无明显变化 |
| Ⅳ |
稀硫酸中加入硝酸钠溶液 |
无明显变化 |
| 再加入该单质a |
有无色气泡;溶液变蓝 |
①实验Ⅰ、Ⅱ、Ⅲ的目的是
说明钠离子、硫酸根离子、硝酸根离子均不能单独使铜溶解
说明钠离子、硫酸根离子、硝酸根离子均不能单独使铜溶解
.
②实验Ⅳ中反应的本质是(用离子方程式表示)
3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
.
③将该单质a加入到混有硫酸的过氧化氢溶液中,溶液逐渐变成蓝色,该反应的离子方程式是
Cu+2H++H2O2=Cu2++2H2O
Cu+2H++H2O2=Cu2++2H2O
.

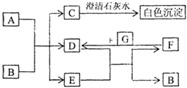 图中A~G均为中学化学中常见的物质,它们之间有如下转化关系.其中A、G为非金属单质,A为黑色固体、G为气态;D、F都是大气污染物,主要来源于汽车尾气,而且D为红棕色.请回答以下问题:
图中A~G均为中学化学中常见的物质,它们之间有如下转化关系.其中A、G为非金属单质,A为黑色固体、G为气态;D、F都是大气污染物,主要来源于汽车尾气,而且D为红棕色.请回答以下问题:
