
题目列表(包括答案和解析)
微生物对人类有着各种各样的用途,现在生物工程学家利用微生物从矿石中提取金属。铜是一种很有价值的金属,可以从铜矿中提取。微生物法是采用某些细菌能用空气中的氧气氧化硫化铜矿石,把不溶性的硫化铜转化成可溶的硫酸铜。利用细菌提取铜的生产过程:在已有细菌存在的岩石.矿石堆中,喷洒酸水以促进细菌生长;在它们的生长过程中,氧化而成的硫酸铜形成低浓度的溶液流到矿石堆的底部,再从这种溶液中提取金属铜。水循环使用,再回到矿石堆中。在美国,10%的铜是用这种方法生产的。
试回答下列问题:
(1)细菌把硫化铜氧化为硫酸铜的过程中起了什么作用: 。
(2)从硫酸铜溶液中提取铜,简便而经济的方法是 ;相应的化学方程式为: 。
(3)普通生产铜的方法是在空气中燃烧硫化铜(产物中有一种气态氧化物)。试比较两种方法的优缺点。
。
(4)用一定量的铁与足量的稀H2SO4及足量的CuO制成单质铜,有人设计以下两种方案:①Fe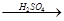 H2
H2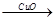 Cu ②CuO
Cu ②CuO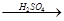 CuSO4
CuSO4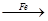 Cu
Cu
若按实验原则进行操作,则两者制得单质铜的量的比较中,正确的是 ( )
| A.①多 | B.②多 | C.相等 | D.无法判断 |
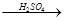 H2
H2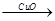 Cu ②CuO
Cu ②CuO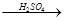 CuSO4
CuSO4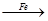 Cu
Cu| A.①多 | B.②多 | C.相等 | D.无法判断 |
(化学与技术,15分)微生物对人类有着各种各样的用途,现在生物工程学家利用微生物从矿石中提取金属。铜是一种很有价值的金属,可以从铜矿中提取。微生物法是采用某些细菌能用空气中的氧气氧化硫化铜矿石,把不溶性的硫化铜转化成可溶的硫酸铜。利用细菌提取铜的生产过程:在已有细菌存在的岩石、矿石堆中,喷洒酸水以促进细菌生长;在它们的生长过程中,氧化而成的硫酸铜形成低浓度的溶液流到矿石堆的底部,再从这种溶液中提取金属铜。水循环使用,再回到矿石堆中。在美国,10%的铜是用这种方法生产的。
试回答下列问题:
(1)细菌把硫化铜氧化为硫酸铜的过程中起了什么作用:
(2)从硫酸铜溶液中提取铜,简便而经济的方法是 ;相应的化学方程式为: 。
(3)普通生产铜的方法是在空气中燃烧硫化铜(产物中有一种气态氧化物)。试比较两种方法的优缺点。
(4)用一定量的铁与足量的稀H2SO4及足量的CuO制成单质铜,有人设计以下两种方案:①FeH2Cu ②CuOCuSO4Cu
若按实验原则进行操作,则两者制得单质铜的量的比较中,正确的是 ( )
| A.①多 | B.②多 | C.相等 | D.无法判断 |
(化学与技术,15分)微生物对人类有着各种各样的用途,现在生物工程学家利用微生物从矿石中提取金属。铜是一种很有价值的金属,可以从铜矿中提取。微生物法是采用某些细菌能用空气中的氧气氧化硫化铜矿石,把不溶性的硫化铜转化成可溶的硫酸铜。利用细菌提取铜的生产过程:在已有细菌存在的岩石、矿石堆中,喷洒酸水以促进细菌生长;在它们的生长过程中,氧化而成的硫酸铜形成低浓度的溶液流到矿石堆的底部,再从这种溶液中提取金属铜。水循环使用,再回到矿石堆中。在美国,10%的铜是用这种方法生产的。
试回答下列问题:
(1)细菌把硫化铜氧化为硫酸铜的过程中起了什么作用:
(2)从硫酸铜溶液中提取铜,简便而经济的方法是 ;相应的化学方程式为: 。
(3)普通生产铜的方法是在空气中燃烧硫化铜(产物中有一种气态氧化物)。试比较两种方法的优缺点。
(4)用一定量的铁与足量的稀H2SO4及足量的CuO制成单质铜,有人设计以下两种方案:①FeH2Cu ②CuOCuSO4Cu
若按实验原则进行操作,则两者制得单质铜的量的比较中,正确的是 ( )
A.①多 B.②多 C.相等 D.无法判断
(5)工业上可用Cu2S和O2反应制取粗铜,该反应中氧化剂为____________.电解粗铜制取精铜,电解时,阳极材料是__________,电解液中必须含有的阳离子是________.
(6)工业上制备氯化铜时,是将浓盐酸用蒸气加热至80℃左右,慢慢加入粗制氧化铜粉末(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO+2HCl===CuCl2+H2O FeO+2HCl===FeCl2+H2O
已知:pH≥9.6时,Fe2+以Fe(OH)2形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完 全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.除去溶液中的Fe2+,可以采用的方法是
2012年10月8日发布的修订版《机动车驾驶证申领和使用规定》,以其对违章驾驶员的严厉惩罚被人们称为“史上最严交规”,其中饮酒后驾驶机动车的一次记12分。利用如下测试管可检测司机是否酒后驾车,化学原理如下:

金属铬在化合物中主要有+3价和+6价两种价态。+6价铬化合物K2CrO4和K2Cr2O7在水溶液中分别呈黄色和橙色,它们在溶液中存在如下平衡关系:2CrO42-+2H+ Cr2O72-+H2O在酸性条件下+6价铬化合物具有强氧化性,可以将C2H5OH氧化为CH3COOH,本身被还原为Cr3+,Cr3+在水溶液中呈灰绿色。
Cr2O72-+H2O在酸性条件下+6价铬化合物具有强氧化性,可以将C2H5OH氧化为CH3COOH,本身被还原为Cr3+,Cr3+在水溶液中呈灰绿色。
(1)根据上述条件可知,在强酸性条件下+6价铬主要以 (填“CrO2-4”或“Cr2O2-7”)形式存在。如果司机酒后驾车,则测试管中的现象是 且超过法定警界线,反应的离子方程式为 。
(2)研究发现+6价铬的毒性为+3价铬的毒性的100~200倍,有多种方法可以将废水中的+6价铬转化为+3价铬以降低毒性。其中两种方法如下:
方法一:电化学方法。将含Cr2O2-7的酸性废水加适量NaCl搅拌均匀并以Fe作电极进行电解。在阳极产生的Fe2+将Cr2O2-7还原为Cr3+,在电解过程中溶液的pH不断上升,最终Cr3+和Fe3+以Cr(OH)3和Fe(OH)3沉淀的形式析出。
①请分析溶液pH不断上升的原因: 。
②已知Fe3+和Cr3+变为Fe(OH)3和Cr(OH)3沉淀的pH如下表:

当溶液的pH范围为____时,溶液中Fe3+已沉淀完全而Cr3+还没有开始沉淀。
③当电路中通过3mol电子时,理论可还原Cr2O2-7的物质的量为 mol。
方法二:还原沉淀法。将l0ml某含铬(Cr2O2-7)废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀,该沉淀经干燥后为nmolFeO·FeyCrxO3。
④不考虑处理过程中的实际损耗,下列叙述错误的是
A.反应中发生转移的电子个数为3nx
B.该废水中c(Cr2O2-7)为50nx mol/L
C.消耗硫酸亚铁铵的物质的量为n(l+y)mol
D.在FeO·FeyCrxO3中,x+y=2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com