
题目列表(包括答案和解析)
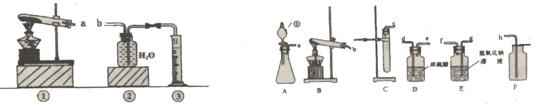
15.实验小组用下图的装置进行实验。
第15题图 第16题图
|
实验步骤 |
简答 |
|
第一步:称取3g氯酸钾与少量二氧化锰混合后放入装置①的试管中,点燃酒精灯。 |
装置①的试管中发生反应的化学方程式:____________________________________ |
|
第二步:加热试管一段时间后,用橡皮管连接a、b。 |
刚开始加热时,排出的气体不宜立即收集,原因是__________________________________ |
|
第三步:当装置②中水面不再下降,断开a、b,移去酒精灯,将装置②中的集气瓶密封,并贴上标签备用。 |
 |
|
第四步:读取量筒里水的体积数并记录。 |
读数时,视线必须与液体凹液面的_________保持水平。 |
在理解上述实验的基础上,请你归纳本实验的目的:(不超过20个字)__________________________。
14.请按右图给出的条件进行实验,你能观察到什么现象(至少答5点),为什么?
(提示:某些非金属氧化物能和水反应生成酸,如:CO2 + H2O == H2CO3)
13.科学探究是奇妙的过程,请你一起参与实验探究,并填写下列空白。
(1)提出问题:小松同学用“双氧水”(过氧化氢)清洗伤口时,不小心将过氧化氢溶液滴到水泥地板上,发现有大量的气泡产生。小松联想到自己曾经用二氧化锰做过氧化氢的催化剂。他想,水泥块能否也可以做过氧化氢分解的催化剂呢?于是他到附近建筑工地取回一些小水泥块,并用蒸馏水浸泡、冲洗、干燥,并进行以下探究。
(2)猜想:水泥块能做过氧化氢的催化剂。
(3)实验验证
|
|
实验步骤 |
实验现象 |
实验结论 |
|
实验一 |
|
木条不复燃 |
常温下过氧化氢溶液不分解 |
|
实验二 |
在装有过氧化氢溶液的试管中加入水泥块,然后将带火星的木条伸入试管中 |
木条复燃 |
________________________ |
(4)结论:水泥块能加快过氧化氢的分解速率,故水泥块能做过氧化氢分解的催化剂。
(5)讨论与反思:小芳认为:仅凭上述两个实验还不能证明水泥块为过氧化氢分解的催化剂,她觉得需要增加一个探究实验,探究____________________________________________。
实验步骤:①准确称量水泥块的质量;②完成实验二;③待反应结束,将实验二试管里的物质进行过滤、洗涤、_________、_________;④对比反应前后水泥块质量。
分析:如果水泥块反应前后质量不变,则说明水泥块可以做过氧化氢分解的催化剂。
(6)但小华认为,要证明小松的猜想,小芳的补充实验还不够,还需要再补充一个探究实验,探究____________________________________________。
12.在实验室里,常用分解过氧化氢(H2O2)的方法制取氧气。
|
(1)实验室里现有20%的H2O2溶液34g,欲将其稀释成10%的溶液,需加水多少克?
(2)若用上述溶液来制取O2,理论上能制得氧气多少克?
10.请你用化学方法设计一组对比实验,并填写实验报告。
实验名称:验证氧气的密度大于空气。
实验目的:利用氧气的性质,通过对比实验验证氧气的密度大于空气。
实验器材:①已集满氧气盖上玻璃片的集气瓶2个 ②木条1根 ③火柴 ④酒精灯
实验报告:
|
实验过程 |
实验现象 |
解释 |
|
|
|
|
|
|
|
结论 |
经上述对比实验得出:相同条件下,氧气的密度比空气大 |
||
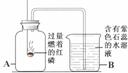
 11.过氧化氢(H2O2)溶液在MnO2做催化剂的条件下,能迅速分解生成O2和H2O。分液漏斗可以通过调节活塞控制液体的滴加速度。现欲制取干燥而纯净的氧气,可采用右图装置。回答下列问题:
11.过氧化氢(H2O2)溶液在MnO2做催化剂的条件下,能迅速分解生成O2和H2O。分液漏斗可以通过调节活塞控制液体的滴加速度。现欲制取干燥而纯净的氧气,可采用右图装置。回答下列问题:
(1)分液漏斗中盛放的物质是_____________;
(2)装置B中的药品是_____________;
(3)A中发生反应的化学方程式是_______________________________;
(4)用该实验代替加热KMnO4制取O2,优点是____________(填序号)。
①生成物只有氧气 ②不需加热 ③生成氧气多
(5)如果要确认C中气体已经干燥,则需在B和C之间连接一个U形管,U形管中应放的物质为___________________。
(6)若改变装置A中的药品,此套装置还可以用来制取_____________气体。
9.空气的主要成分是N2和O2,在通常状况下,它们不发生反应。但是,在放电条件下,N2和O2却可以直接化合,生成无色、不溶于水的NO气体。NO在常温下很容易跟空气中的O2化合,生成红棕色的NO2气体。NO2是一种有毒气体,易溶于水,它与水反应生成HNO3和NO。请按要求填写下列空白:
(1)在实验室收集一瓶NO气体,应采用的收集方法是____________________________。
(2)CO和NO是不同的物质,但它们在性质上有相似之处,请写出一条相似的化学性质:__________________________________________________。
(3)NO2和NO都属于__________________。(填“酸”、“碱”、“盐”或“氧化物”)
(4)在N2→NO→NO2→HNO3的变化中氮元素的化合价变化的规律是________________。
8.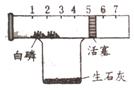 利用右边的装置也可以粗略地测定空气的组成。如右图所示,玻璃管中有一可左右移动的活塞,活塞左端密封有空气,活塞右端的玻璃管口与大气相通。烧杯中加入了适量的生石灰,再向烧杯中加入水(生石灰可与水发生反应,并放出大量的热,使注射器中的白磷自发地燃烧)后,观察实验现象,回答下列问题:
利用右边的装置也可以粗略地测定空气的组成。如右图所示,玻璃管中有一可左右移动的活塞,活塞左端密封有空气,活塞右端的玻璃管口与大气相通。烧杯中加入了适量的生石灰,再向烧杯中加入水(生石灰可与水发生反应,并放出大量的热,使注射器中的白磷自发地燃烧)后,观察实验现象,回答下列问题:
(1)注射器内的白磷与红磷组成相同,所以白磷燃烧产生了______________________现象,反应的化学方程式:_________________________________。此时活塞会向______移动,因为_______________________________________。
(2)实验结束后,恢复到原来温度,活塞应停留在约____________cm处,通过实验可得出的正确结论是_________________________。
(3)已知镁+氧气 氧化镁(固体),镁+氮气
氧化镁(固体),镁+氮气 氮化镁(固体)。想一想,能否用镁代替磷来测定空气中氧气的含量?为什么?
氮化镁(固体)。想一想,能否用镁代替磷来测定空气中氧气的含量?为什么?
7.亚硝酸钠(NaNO2)的外观与食盐很相似,有咸味,误食易中毒。区别它们一种方法是:将两者分别加热到320℃,不分解的是食盐,能分解并放出一种具有刺激性气味气体的亚硝酸钠。该气体可能是 ( )
A.NH3 B.SO2 C.NO2 D.N2
6.下表是某城市空气质量日报的部分内容:
|
项 目 |
空气污染指数 |
空气质量级别 |
空气质量描述 |
|
总悬浮颗粒物 |
52 |
Ⅱ |
良 |
|
二氧化硫 |
7 |
||
|
二氧化氮 |
24 |
下列情况对表中三个空气质量指标影响最小的是 ( )
A.用燃气公司供应的天然气作燃料 B.焚烧生活垃圾
C.汽车尾气的排放 D.用煤和石油作燃料
5.我们知道食物较长时间露置在空气中就会变质,主要是由于空气中含有 ( )
A.氧气 B.氮气 C.二氧化碳 D.稀有气体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com