
题目列表(包括答案和解析)
3.实验室制取二氧化碳气体,反应物的状态为_________和_________反应,反应_________(填“需要”或“不需要”)加热,所以选择的气体发生装置简称为固液常温型;又由于生成的二氧化碳气体密度比空气_________,_________溶于水,且二氧化碳还能与水发生反应,所以选择的收集方法只能是_________。
思路解析:反应物的状态和反应条件,决定了制备装置的选择。固液型装置且不需要加热决定了装置应该选择启普发生器或其简易装置。
答案:固体 液体 不需要 大 能 向上排空气法
10分钟训练 (强化类训练,可用于课中)
2.实验室里制取气体的装置包括___________和_________两部分。确定气体的发生装置应考虑的因素是_________和_________,确定气体的收集装置应考虑的因素是气体的_________和_________等。
思路解析:本题考查实验室制备气体时装置的选择原则和气体收集时需要考虑的主要因素。
答案:发生装置 收集装置 反应物的状态 反应条件 密度 水溶性
1.实验室里制取CO2的药品是_________,化学反应方程式为___________________________;收集CO2的方法是___________________________;检验CO2的方法是_________________;验满CO2的方法是______________________________________________________
思路解析:本题考查实验室制取二氧化碳的反应原理和收集、检验、验满二氧化碳的方法和过程,考查对该实验基本知识的掌握。
答案:大理石或石灰石与稀盐酸CaCO3+2HCl====CaCl2+ CO2↑+H2O向上排空气法将产生的气体通入澄清的石灰水中,澄清的石灰水变浑浊,则证明产生的气体是二氧化碳将燃着的木条放到集气瓶,若木条熄灭,则证明已满
8.早在17世纪,质量守恒定律发现之前,英国化学家波义耳曾经做过一个实验:在密闭的容器中燃烧金属时,得到了金属灰,然后打开容器盖,称量金属灰的质量,发现比原来金属质量增加了。
(1)试解释金属灰质量比原金属质量增加的原因。
(2)由于波义耳称量方法上的原因,他错过了发现质量守恒定律的机会。请你改进他的称量方法,以验证质量守恒定律。
解答:(1)金属燃烧是金属和氧气发生化合反应,生成金属氧化物。根据质量守恒定律可知,参加反应的金属与氧气的质量之和等于生成的金属氧化物的质量。生成的金属灰是金属氧化物,所以金属灰的质量比原来金属的质量增加了。
(2)分别称量反应前后密闭容器的质量。
13.6克÷85%=16克
答案:(1)12.5 (2)16
0.8x 6.4克 y
 ,x=12.5克
,x=12.5克
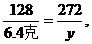 y=13.6克
y=13.6克
7.火力发电厂用石灰石泥浆吸收废气中的二氧化硫以防止污染环境,其反应方程式为:2CaCO3(粉末) + 2SO2+ O2====2CaSO4+ 2CO2。
(1)若100克废气中含6.4克二氧化硫,则处理100克这种废气需含碳酸钙(CaCO3)的石灰石__________克。
(2)处理上述100克废气,可得到含CaSO4 85%的粗产品_________克。
思路解析:题中给出的化学方程式,即为计算的依据。
设需含CaCO3 80%的石灰石的质量为x,生成纯CaSO4的质量为y。
2CaCO3+2SO2+O2====2CaSO4+2CO2
200 128 272
36.5×10% x
x=4 g
污水中所含NaOH的质量分数为: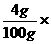 100%=4%。
100%=4%。
答案:(1)4 g(2)4%
36.5 40
6.(2010福建福州中考,30)某综合实践活动小组同学,对我市某化工厂排放的污水进行检测,发现主要的污染物为氢氧化钠。为测定污水中氢氧化钠的含量,取100 g污水于烧杯中,加入36.5 g质量分数为10%的稀盐酸恰好完全反应。(假设污水中其他成分不与稀盐酸反应,反应的化学方程式为:HCl+NaOH====NaCl+H2O)
求:(1)100 g污水中含氢氧化钠多少克?
(2)污水中所含氢氧化钠的质量分数。
思路解析:设100 g污水中含NaOH质量为x。
HCl+NaOH====NaCl+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com