
题目列表(包括答案和解析)
4.下列说法中,正确的是( )
A.水是由一个氧元素和两个氢元素组成的
B.水是由氧和氢两种元素组成的
C.水是由氧和氢两种单质组成的
D.水分子是由氧分子和氢分子构成的
思路解析:A错,元素只能论种类,不能论个数。B对。C、D错,从宏观上说,水是由氧和氢两种元素组成的,水中的氧和氢两种元素已失去了在单质时的性质,不可能含有氧和氢两种单质?分子。?
答案:B
3.某物质只含有一种元素,则该物质( )
A.肯定是纯净物 B.可能是化合物
C.一定是一种单质 D.可能是混合物
思路解析:由一种元素组成的物质不一定是纯净物,如氧气和臭氧混合,虽然只由氧元素组成,但它是混合物。由一种元素组成的物质一定不是化合物。
答案:D
2.下列物质:①氢气②硫磺③二氧化碳④液氧⑤氯化钾⑥矿泉水⑦空气⑧四氧化三铁⑨石灰水⑩铜丝?11生铁?12水(以下空格填序号)
(1)属于混合物________________________。 (2)属于纯净物________________________。
(3)属于化合物________________________。 (4)属于氧化物________________________。
(5)属于金属单质______________________。 (6)属于非金属单质___________________。
思路解析:本题考查学生对物质进行类别归纳的能力。
答案:(1)⑥⑦⑨11? (2)①②③④⑤⑧⑩12? (3)③⑤⑧12? (4)③⑧12? (5)⑩ (6)①②④
1.判断下列叙述的正误,并说出理由。
________________________________________________
(1)二氧化碳是由碳元素和氧元素组成的。
________________________________________________
(2)二氧化碳是由一个碳元素和一个氧元素组成的。
________________________________________________
(3)二氧化碳是由一个碳原子和一个氧分子组成的。
________________________________________________
(4)一个二氧化碳分子是由一个碳原子和两个氧原子构成的。
________________________________________________
思路解析:本题考查有关物质组成和构成的化学用语。
答案:(1)正确。元素和物质是宏观概念,有关物质的组成的叙述中要“宏观对宏观”,即描述物质的组成用元素。
(2)错误。元素只能论种类,不能论个数。
(3)错误。二氧化碳、碳原子和氧分子是三种不同的物质,它们的性质不同,从宏观上说,二氧化碳中含有碳元素和氧元素,从微观上说,一个二氧化碳分子是由一个碳原子和两个氧原子构?成的。?
(4)正确。分子和原子均是微观概念。有关物质的构成的叙述中要“粒子对粒子”,即描述分子的构成用原子。
2.地壳里含量前四位的元素顺序是____________、____________、____________、____________。
思路解析:本题考查学生对元素在地壳中含量的识记能力。平时学习时要有意识地按知识点进行归纳。
答案:氧 硅 铝 铁
10分钟训练 (强化类训练,可用于课中)
1.元素是宏观概念,是对物质的组成而言的。元素就是具有相同____________即____________的一类原子的总称。决定元素种类的是____________;不同种元素之间最本质的区别是____________。
思路解析:本题考查元素的概念。质子数的多少决定元素的本质和种类。
答案:核电荷数 相同质子数 核内质子数 质子数不同
15、取一定质量的CO和CO2的混合气体,通入足量的Ba(OH)2溶液中,充分反应后过滤,发现生成的沉淀和所取的混合气体质量相等.求混合气体中,碳原子与氧原子的个数比
10、小强的妈妈要焙制面包,叫小强去商店买回一包纯碱,小强仔细看了包装说明(如下图),并产生疑问。回到学校,他取出从家里带来的一小包纯碱样品进行实验:准确称取5.5 g样品放入烧杯中,在滴加盐酸至刚好完全反应时,共用去稀盐酸25 g,所得溶液质量为28.3 g(杂质溶于水但与盐酸不反应)。求:
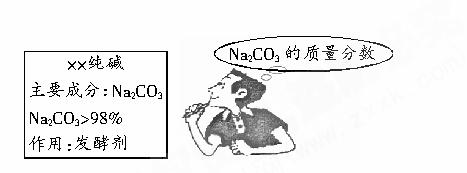
(1)生成CO2的质量为____________。 (2)通过计算判断纯碱样品中碳酸钠的质量分数是否与包装说明相符。
[解析](1)根据质量守恒定律,混合后物质减少的质量即为生成CO2质量,25 g+5.5 g-28.3 g=2.2 g。
(2)解:设5.5 g纯碱样品中碳酸钠的质量为x。
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 2.2 g
106/44=x/2.2g x=5.3 g
5.3 g/5.5g×100%=96%<98%,所以该纯碱样品中碳酸钠的质量分数与包装说明不符。
[易错点点睛]本题要求同学们不但要会计算,更重要的是要学会分析,即从所给标签中挖掘计算所需要的信息,如物质名称、性质、含量(纯度)等,然后结合所学的知识进行解答。
11、2007年9月2日,我省清流县一载满浓硫酸的罐车翻倒,导致26 t溶质质量分数为98%的浓硫酸泄漏,流入附近小溪中。闻讯赶来的武警官兵立即垒坝并用石灰浆(主要成分是氢氧化钙)中和硫酸。计算:中和泄漏的硫酸,理论上需要多少吨氢氧化钙?(计算结果精确到0.1)
[解析]本题是利用化学方程式进行的简单计算。 由题可知,参加反应的硫酸的质量为26 t×98%=25.48 t,根据化学方程式列出相应的比例式,将此数据代入计算式即可解答。
答案:解:设理论上需要氢氧化钙的质量为x。
硫酸溶液中溶质的质量=26 t×98%=25.48 t
H2SO4+Ca(OH)2 = CaSO4+2H2O
98 74
25.48 t x
98/74=25.48 t/x x=19.2
t
答:理论上需要氢氧化钙的质量为19.2 t。
[易错点点睛]这是一类比较简单的计算题型,正确解答这类题的关键是将不纯物质的质量转化成纯净物的质量,再代入化学方程式中进行计算。
12、某化学兴趣小组为了测定一批石灰石样品中碳酸钙的质量分数,取用8 g石灰石样品,把40 g稀盐酸分4次加入样品中(杂质既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下:
由题可知,参加反应的硫酸的质量为26 t×98%=25.48 t,根据化学方程式列出相应的比例式,将此数据代入计算式即可解答。
答案:解:设理论上需要氢氧化钙的质量为x。
硫酸溶液中溶质的质量=26 t×98%=25.48 t
H2SO4+Ca(OH)2 = CaSO4+2H2O
98 74
25.48 t x
98/74=25.48 t/x x=19.2
t
答:理论上需要氢氧化钙的质量为19.2 t。
[易错点点睛]这是一类比较简单的计算题型,正确解答这类题的关键是将不纯物质的质量转化成纯净物的质量,再代入化学方程式中进行计算。
12、某化学兴趣小组为了测定一批石灰石样品中碳酸钙的质量分数,取用8 g石灰石样品,把40 g稀盐酸分4次加入样品中(杂质既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下:


(1)从以上数据可知,这四次实验中,第_______次实验后石灰石样品中的碳酸钙已完全反应。
(2)求石灰石样品中碳酸钙的质量分数。
(3)上表中M的数值应 为多少?
(4)足量盐酸与100 t这种石灰石反应,能得到二氧化碳的质量是多少?
为多少?
(4)足量盐酸与100 t这种石灰石反应,能得到二氧化碳的质量是多少?
 13、刘明用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他决定利用该废液,测定Na2CO3溶液中溶质的质量分数。他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如右图所示。
13、刘明用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他决定利用该废液,测定Na2CO3溶液中溶质的质量分数。他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如右图所示。
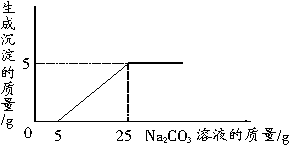
(1)在加入Na2CO3溶液的过程中,开始时没有发现沉淀生成,说明废液中的溶质除含有CaCl2外,还含有_________。
(2)计算Na2CO3溶液中溶质的质量分数(计算结果精确到0.1%)。
[解析]石灰石与稀盐酸反应后的废液中一定有CaCl2,此外还可能含有反应中过量的稀盐酸,分析坐标图可知,当加入5 g碳酸钠溶液时没有产生沉淀,由此可知废液中除含有CaCl2外,还一定含有盐酸,开始加入的5 g碳酸钠溶液先与废液中剩余的盐酸发生反应,故没有沉淀出现。再由坐标图的拐点知,向废液中加入25 g碳酸钠溶液时产生了5 g沉淀,即与废液中的氯化钙反应的Na2CO3溶液的质量为25 g-5 g=20 g,同时生成5 g碳酸钙沉淀,以此为突破口,根据化学方程式进行计算即可。 答案:(1)HCl
(2)解:由图像可知,有25 g-5 g=20 g Na2CO3溶液与氯化钙溶液发生反应,生成5 g碳酸钙沉淀。
设20 g Na2CO3溶液中溶质的质量为x。
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100
x 5 g
106/100=x/5 g x=5.3 g
该Na2CO3溶液中溶质的质量分数为:5.3 g/20 g×100%=26.5%
答:Na2CO3溶液中溶质的质量分数为26.5%。
[易错点点睛]解答坐标图像题的突破口一般为曲线上的两个点,即起点和拐点(或终点),准确分析并理解两点对应的纵、横坐标数据的意义是解题的关键,找出解题所需数据后,按照化学方程式计算 或溶液中溶质质量分数计算的方法进行解答即可。
14、近年来,“非典”、“禽流感”等由病毒引起的传染病一直困扰着人类,消毒剂的选择、使用以及相关问题的探讨与研究就成了热门话题。常见的消毒剂有:84消毒液、过氧乙酸(CH3COOOH)溶液、双氧水溶液、醋酸(CH3COOH)溶液
或溶液中溶质质量分数计算的方法进行解答即可。
14、近年来,“非典”、“禽流感”等由病毒引起的传染病一直困扰着人类,消毒剂的选择、使用以及相关问题的探讨与研究就成了热门话题。常见的消毒剂有:84消毒液、过氧乙酸(CH3COOOH)溶液、双氧水溶液、醋酸(CH3COOH)溶液 等,以下是某班同学开展研究性学习的相关问题:
(1)为了便于研究,小明计算出过氧乙酸的相对分子质量为__________。
(2)小敏问小明:相同分子数的过氧乙酸和醋酸,所含氧原子的个数比是多少?
小明答_________。
(3)小丽想配制2%的双氧水溶液,已经有4%的双氧水溶液100 g,所需水的质量为____。
(4)小亮用100 g一定溶质质量分数的醋酸溶液与足量碳酸钠反应,反应的化学方程式为:2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑并将生成的气体通入足量的NaOH浓溶液,测得NaOH浓溶液增重4.4 g,请你帮他算出原醋酸溶液的溶质质量分数。
等,以下是某班同学开展研究性学习的相关问题:
(1)为了便于研究,小明计算出过氧乙酸的相对分子质量为__________。
(2)小敏问小明:相同分子数的过氧乙酸和醋酸,所含氧原子的个数比是多少?
小明答_________。
(3)小丽想配制2%的双氧水溶液,已经有4%的双氧水溶液100 g,所需水的质量为____。
(4)小亮用100 g一定溶质质量分数的醋酸溶液与足量碳酸钠反应,反应的化学方程式为:2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑并将生成的气体通入足量的NaOH浓溶液,测得NaOH浓溶液增重4.4 g,请你帮他算出原醋酸溶液的溶质质量分数。
[解析]本题融化学式计算、溶液计算和化学方程式计算于一体,(1)(2)两问可由化学式直接计算得出。(3)由4%的溶液稀释为2%的溶液,溶质质量分数减小一半,则需加入相当于原溶液质量(即100 g)的水;也可利用稀释前后溶液中溶质的质量不变,列式计算。(4)本题看似复杂,其实只要理解“增重4.4 g”的意义,也可化为简单的化学方程式计算。“4.4 g”是浓NaOH溶液吸收的二氧化碳的质量,也即醋酸与碳酸钠反应生成二氧化碳的质量,由此根据所给化学方程式可求得醋酸的质量,进而求出醋酸溶液的溶质质量分数。 答案:(1)76 (2)3∶2 (3)100 g (4)解:设100 g醋酸溶液中醋酸的质量为x。 2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑ 120 44 x 4.4 g 120/44=x/4.4 g x=12 g 醋酸溶液的溶质质量分数=12 g/100 g ×100%=12% 答:略 [易错点点睛]解答有关化学方程式和溶液的综合计算题时要注意:①化学方程式下相对应的物质质量不能直接写溶液质量,而要写参加化学反应的溶质的实际质量;②反应后所得溶液的质量可利用“原溶液的质量+新溶解的物质的质量-反应生成的气体或沉淀的质量”计算得出。
9、在一烧杯中盛有100 gCuSO4和H2SO4的混合溶液向其中逐渐滴加溶质质量分数为10%的NaOH溶液,混合溶液的质量与所滴入NaOH溶液的质量关系曲线如右图所示。请 根据题意回答下列问题
根据题意回答下列问题 :
:
(1)在实验过程中产生沉淀的总质量是______ g。
(2)在实验过程中加入80 gNaOH溶液时所得溶液的pH是___ _7 (填“大于”“小于”或“等于”)。
(3)在实验过程中加入80 gNaOH溶液时,通过计算求此时所得不饱和溶液中溶质的质量分数。(计算结果精确至0.1%)
[解析]由图像知,NaOH溶液的质量在0~40 g之间并没有沉淀产生,故先发生的反应是:2NaOH+H2SO4=Na2SO4+2H2O。NaOH溶液的质量在40 g~80 g之间,沉淀质量随着加入Na OH溶液质量的增加而逐渐达到最大值,故发生:2NaOH+CuSO4=Na2SO4+Cu(OH)2↓。在NaOH溶液加至80 g时,两个反应刚好结束,所得溶液中溶质只有硫酸钠且质量为上述两个反应产生的硫酸钠质量之和。
OH溶液质量的增加而逐渐达到最大值,故发生:2NaOH+CuSO4=Na2SO4+Cu(OH)2↓。在NaOH溶液加至80 g时,两个反应刚好结束,所得溶液中溶质只有硫酸钠且质量为上述两个反应产生的硫酸钠质量之和。
答案:(1)4.9 g;(2)等于;
(3)解:设与硫酸反应生成的碳酸钠质量为x,与硫酸铜反应生成的硫酸钠质量为y,
2NaOH+H2SO4=Na2SO4+2H2O
80 142
40 g×10% x
解得:x=7.1 g;
2NaOH + CuSO4 = Na2SO4+ Cu(OH)2↓
80 142
(80 g-40 g)×10% y
解得:y=7.1 g;
不饱和溶液中Na2SO4总质量为: 7.1 g+7.1 g = 14.2 g;
不饱和溶液的质量为: 100 g+80 g-4.9 g = 175.1 g;
所得不饱和溶液中Na2SO4质量分数: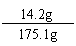 ×100%=8.1%。
×100%=8.1%。
答:略。
[易错点点睛]此题较前面两个例题复杂,解题的关键是根据图像的分段,能够意识到反应发生的先后顺序,能够理解几个特殊点的化学含义。在求不饱和溶液中硫酸钠质量时,还可以根据元素守恒思想,建立H2SO4和Na2SO4的对应关系,根据硫酸的总质量一步求出硫酸钠质量。
8、 向盛有22.3 g Na2CO3和NaCl固体混合物的烧杯中加入216.1 g稀盐酸恰好反应,反应过程用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如下图所示:烧杯连同药品的起始质量为300 g。
向盛有22.3 g Na2CO3和NaCl固体混合物的烧杯中加入216.1 g稀盐酸恰好反应,反应过程用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如下图所示:烧杯连同药品的起始质量为300 g。
 回答下列问题:
回答下列问题:
(1)当固体混合物与稀盐酸恰好完全反应时,所需时间约为 S。
 (2)完全反应后,产生二氧化碳气体质量 g。
(2)完全反应后,产生二氧化碳气体质量 g。
(3)反应后,得到室温下的不饱和溶液。所得溶液中溶质的质量分数为多少?
[解析]由图像变化趋势可知:从0~20秒,m逐渐减少,其原因必然是碳酸钠与盐酸反应产生二氧化碳气体跑出去了;从20秒开始,m不变了,即盐酸与碳酸钠反应结束了。故:二氧化碳的质量为300 g-295.6 g=4.4 g,然后据此代 入化学方程式即可求出反应产生的碳酸钠。
入化学方程式即可求出反应产生的碳酸钠。
答案:( 1)20;
(2)4.4 g;
1)20;
(2)4.4 g;
(3)解:设参加反应的碳酸钠的质量为x,反应生成的氯化钠的质量为y
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
106 117 44
x y 4.4
解得:x=10.6 g,y=11.7 g;
烧杯里不饱和溶液中溶质总质量为: 11.7 g + (22.3 g-10.6 g) = 23.4 g;
烧杯里不饱和溶液的质量为: 22.3 g+216.1 g-4.4 g = 234 g;
所得不饱和溶液的溶质质量分数: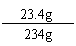 ×100%=10%。
×100%=10%。
答:略。
[易错点点睛]此题与例1的难度和所考知识点相似,此题的易错点是溶液质量弄错,容易把295.6  g当作溶液的质量,另外容易忽视二氧化碳的质量。
g当作溶液的质量,另外容易忽视二氧化碳的质量。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com