
题目列表(包括答案和解析)
8.(2010·长沙模拟)在配制一定物质的量浓度的盐酸时,下列错误操作可使所配制溶液的浓度偏高的是 ( )
A.用量筒量取浓盐酸时俯视量筒刻度进行读数
B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶瓶颈刻度线
D.摇匀后见液面下降,再加水至刻度线
解析:用量筒量取浓盐酸时俯视量筒进行读数,实际液面在所需体积刻度线的下方,即量取盐酸的体积比所需盐酸体积小,致使所配制溶液的浓度偏低;溶解搅拌时有液体飞溅,溶质有损失,致使所配制溶液的浓度偏低;摇匀后见液面下降,再加水至刻度线,就等于多加了水,使所配制溶液的浓度偏低;定容时俯视容量瓶瓶颈刻度线,使实际液面低于容量瓶的刻度线,致使所配制溶液的浓度偏高.
答案:C
7.实验室中需要配制2 mol/L的NaCl溶液950 mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是 ( )
A.950 mL 111.2 g B.500 mL 117.0 g
C.任意规格 111.2 g D.1000 mL 117.0 g
解析:考虑到容量瓶的规格,没有950 mL的规格,只能选用1000 mL的容量瓶.故m÷58.5 g/mol÷1 L=2 mol/L,解 得m=117.0 g.
答案:D
6.在标准状况下,将V L A气体(摩尔质量是M g/mol)溶于0.1 L水中,所得溶液的密度为d g/cm3,则此溶液的物质的量浓度为 ( )
A. B.
C. D.
解析:由题知气体A的物质的量为 mol,溶剂是0.1 L H2O(100 g),溶液的质量是(100+·M)g,已知溶液密度为d,溶液的体积应是(100+·M)/d,整理后得到体积为() mL.因此,溶液的物质的量浓度为=(mol/L).
答案:B
5.甲、乙两物质的溶解度曲线如图所示.下列叙述中,正确的是 ( )
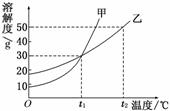
A.t1℃时,在100 g水中放入60 g甲,其溶质的质量分数为37.5%
B.t1℃时,甲和乙的饱和溶液的物质的量浓度一定相等
C.t2℃时,甲和乙的饱和溶液中溶质的质量分数一定相等
D.t2℃时,分别在100 g水中各溶解20 g甲、乙,同时降低温度,甲先达到饱和
解析:t1℃时甲、乙的饱和溶液的质量分数均约为23%;t1℃时,100 g水中溶解的甲、乙的质量相等,但两者的物质的量不一定相等;t2℃时,甲的饱和溶液的质量分数比乙的大.故A、B、C均错误.
答案:D
4.(2009·浙江高考)已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高.则下列溶液沸点最高的是 ( )
A.0.01 mol/L的蔗糖溶液
B.0.01 mol/L的CaCl2溶液
C.0.02 mol/L的NaCl溶液
D.0.02 mol/L的CH3COOH溶液
解析:据题意,1 L溶液中,沸点高低取决于非挥发性溶质的分子或离子的数目.D项,因CH3COOH易挥发而排除;A项,蔗糖是非电解质,溶液中只有0.01NA个蔗糖分子;B项,共有0.03NA个离子;C项,共有0.04NA个离子.
答案:C
3.用10 mL 0.1 mol/L的BaCl2溶液可分别使相同体积的Fe2(SO4)3、ZnSO4和K2SO4三种溶液中的SO完全转化为BaSO4沉淀,则三种硫酸盐溶液的物质的量浓度之比是
( )
A.3∶2∶2 B.1∶2∶3
C.1∶3∶3 D.3∶1∶1
解析:此题虽给出BaCl2溶液的量,但求的是硫酸盐溶液的物质的量浓度之比,为简化运算,可抛开BaCl2的给出量而设BaCl2为1 mol,由Fe2(SO4)3、ZnSO4、K2SO4的化学式可看出,沉淀1 mol Ba2+需SO 1 mol,而需三种盐的物质的量分别是 mol、1 mol、1 mol,又因三种盐溶液的体积相同,物质的量浓度之比等于物质的量之比,为∶1∶1=1∶3∶3.
答案:C
2.用单位质量的溶剂中所含溶质的物质的量来表示的溶液浓度叫做质量物质的量浓度,其单位为mol/kg,若5 mol/kg的H2SO4溶液的密度为1.30 g/mL,则它的物质的量浓度为 ( )
A.3.56 mol/L B.4.36 mol/L C.5.00 mol/L D.5.25 mol/L
解析:质量物质的量浓度为5 mol/kg的H2SO4溶液即1 kg 水中溶解5 mol H2SO4的溶液.m(溶液)=(1000+5×98) g=1490 g;
V(溶液)=== mL= L;
c(溶液)==4.36 mol/L.
答案:B
1.(2009·济南模拟)下列说法中错误的是 ( )
A.从1 L 1 mol/L的NaCl溶液中取出10 mL,其浓度仍是1 mol/L
B.制成0.5 L 10 mol/L的盐酸,需要氯化氢气体112 L(标准状况)
C.0.5 L 2 mol/L BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D.10 g 98%的硫酸(密度为1.84 g/cm3)与10 mL 18.4 mol/L硫酸的浓度是不同的
解析:溶液是均一稳定的,A正确;0.5 L×10 mol/L=5 mol,5 mol×22.4 L/mol=112 L,B正确;N(Ba2+)+N(Cl-)=(0.5 L×2 mol/L+0.5 L×2 mol/L×2)×6.02×1023=3×6.02×1023,C正确;98%的硫酸密度为1.84 g/cm3,其浓度为18.4 mol/L,D不正确.
答案:D
14.(15分)(2009·全国卷Ⅱ)化合物A相对分子质量为86,碳的质量分数为55.8%,氢
为7.0%,其余为氧.A的相关反应如下图所示:
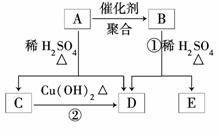
已知R-CH===CHOH(烯醇)不稳定,很快转化为R-CH2CHO.
根据以上信息回答下列问题:
(1)A的分子式为______________;
(2)反应②的化学方程式是_______________________________________________;
(3)A的结构简式是______________;
(4)反应①的化学方程式是_________________________________________________;
(5)A有多种同分异构体,写出四个同时满足(i)能发生水解反应(ii)能使溴的四氯化碳
溶液褪色两个条件的同分异构体的结构简式:__________、____________、
________________、________________;
(6)A的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简式为
_______________________________________________________________________.
解析:(1)化合物A分子中含C原子数:=4,含H原子数:=6,
含O原子数:
=2,所以A的分子式为C4H6O2.由转化关系A稀H2SO4△C+D,
而CCu(OH)2△D,可判断C、D中含碳原子数相同,C是烯醇转化成的醛,D是羧酸,
再结合A的分子式C4H6O2可推出C是CH3CHO,D是CH3COOH,
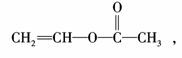
A是
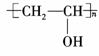
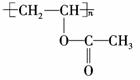 B是
,E是
.
B是
,E是
.
A的同分异构体能发生水解反应,则分子中有酯基,能使溴的四氯化碳溶液褪色,
则分子中有碳碳不饱键,则可写出:HCOOCH===CHCH3、HCOOCH2CH===CH2、
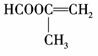 、H2C===CHCOOCH3.A的另一种同分异构体其分子中所有碳原子
、H2C===CHCOOCH3.A的另一种同分异构体其分子中所有碳原子
在一条直线上,则应具有乙炔的直线结构:HOCH2C≡CCH2OH.
答案:(1)C4H6O2
(2)CH3CHO+2Cu(OH)2
CH3COOH+Cu2O+2H2O
(3) 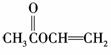
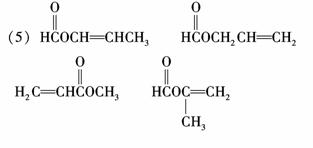
(其他正确答案也给分) (6)HOCH2-C≡C-CH2OH
13.(12分)某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中
含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢.
(1)A的结构简式为_____________________________________________________;
(2)A中的碳原子是否都处于同一平面?________(填“是”或“不是”);
(3)在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体.
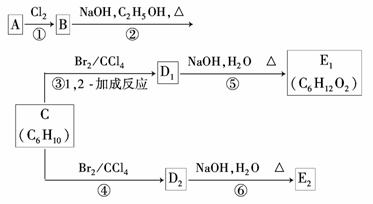
反应②的化学方程式为__________________________;
C的化学名称为_______________________________________________________;
E2的结构简式是________________________________________________________;
④、⑥的反应类型依次是___________________________________________________.
解析:(1)A分子含有双键并且相对分子质量为84,且分子中只有一种类型的H,所以
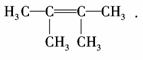 A的结构简式只能为
A的结构简式只能为
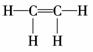
(2)在乙烯的分子结构 中,6个原子在同一平面上,A分子中6个碳原子
与乙烯分子中的6个原子(2个C原子,4个H原子)位置相同,故A中的6个C原子
处于同一平面上.
(3)由题
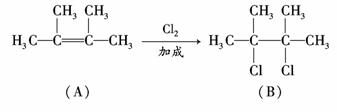
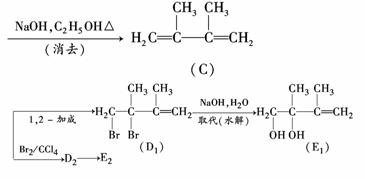
因D1与D2,E1与E2为同分异构体,而CBr2D2仍为加成反应,所以D2只能为1,4?
加成的产物,则D2为
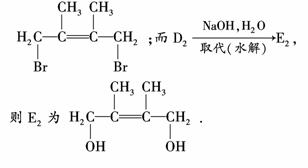
 答案:(1) (2)是
答案:(1) (2)是
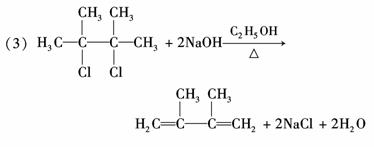
2,3?二甲基?1,3?丁二烯
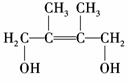
1,4?加成反应、取代反应

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com