
题目列表(包括答案和解析)
5.某一密闭绝热容器中盛有饱和Ca(OH)2溶液,当加入少量CaO粉末,下列说法正确的是
①有晶体析出 ②c[Ca(OH)2]增大 ③pH不变 ④c(H+)c(OH-)的积不变
⑤c(H+)一定增大
A . ① B. ①⑤ C . ①②④ D . ①③
4.钛被誉为“太空金属”,其原因是它的强度大、密度小、抗腐蚀性能好。室温下,它不与水、稀硫酸、稀硝酸反应,但易溶于氢氟酸,推断其原因
A.氟离子易与钛离子形成可溶性难电离物质 B.氢氟酸的氧化性比其它酸强
C.氢氟酸的还原性比其它酸强 D.氢氟酸的酸性比其它酸强
3.一定温度下,在质量都是50 g的五份水中分别加入30g、40g、50g、60g、70gKNO3固体,充分搅拌后,滤去未溶解的KNO3。加入的KNO3质量与相应所得溶液的质量数据见下表:
|
加入KNO3的质量/ g |
30 |
40 |
50 |
60 |
70 |
|
溶液质量/ g |
80 |
90 |
100 |
105 |
105 |
则该温度下KNO3的溶解度是
A.60克 B.80克 C.100克 D.110克
2.核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学论断等高科技领域。已知只有质子数或中子数为奇数的原子核才有NMR现象。试判断下列哪组原子均可产生NMR现象
A.18O 、 31P 、 119Sn B.27Al 、 19F 、 12C
C.元素周期表中VA族所有元素的原子 D.元素周期表中第一周期所有元素的原子
1.下列说法不科学的是
A. 臭氧是饮水的理想消毒剂之一,原因是臭氧杀菌能力强且又不影响水质
B. “水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用生成可溶性的Ca(HCO3)2的缘故
C. 实验室使用“通风橱”防污染是不环保的做法,因为实验产生的有害气体并没有得到转化或吸收
D. 变质的油脂有难闻的气味,是由于油脂与水发生了水解反应
23.(10分)
有机化学反应因反应条件不同,可生成不同的有机产品。例如:
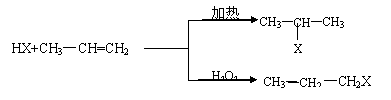
Ⅰ.
Ⅱ.苯的同系物与卤素单质混合,若在光照条件下,侧链上的氢原子被卤素原子取代;若在催化剂作用下,苯环上的氢原子被卤素原子取代。
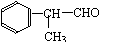
工业上利用上述信息,按下列路线合成结构简式为 的物质,该物质是一种香料。
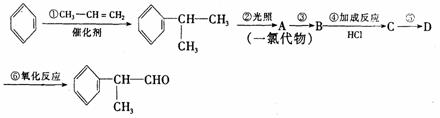
请根据上述路线回答下列问题:
(1)A的结构简式可能为 ;
(2)反应①、③的反应类型分别为 、 ;
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):
;
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化为D的方法,其原因是
;
(5)这种香料具有多种同分异构体,其中某些同分异构体有下列特征:①其水溶液遇FeCl3溶液呈紫色;②分子中有苯环,且苯环上的一溴代物有两种。请写出符合上述条件的同分异构体可能的结构简式(只写两种):
。
泰安市2007年高三年级一轮复习质量检测
22.(9分)为测定一置于空气中的某硫酸酸化的FeSO4溶液中的Fe2+被氧化的百分率,某同学准确量取pH=1(忽略Fe2+、Fe3+的水解)的FeSO4溶液200 mL,加入过量BaCl2溶液,充分反应后过滤、洗涤、干燥,得到沉淀27.96 g;再另取同样的FeSO4溶液200 mL,向其中加入过量NaOH溶液,搅拌使其充分反应,待沉淀全部变为红褐色后,过滤、洗涤并灼烧所得固体,最终得固体8.0 g。
(1)计算该FeSO4溶液中各离子的物质的量浓度并填写下表:
.
|
c( H+)/mol-1 |
c( SO42-)/mol-1 |
c(Fe2+、Fe3+)/mol-1 |
|
|
|
|
注:表示Fe2+和Fe3+的总的物质的量浓度
(2)计算原溶液中Fe2+被氧化的百分率。
21.(8分)化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数的数值如下:
2NO(g) N2(g)+O2(g) K1=1×1030
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g) 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g) 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
请填写下列空白:
(1)常温下,NO分解产生O2的反应的平衡常数表达式为 ;
(2)常温下,水分解产生O2,此时平衡常数的数值约为 ;
(3)常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为
;
(4)随着轿车进入家庭,汽车尾气污染成为备受关注的环境问题,某市政府要求全市新有汽车尾气处理装置完成改装,改装后的尾气处理装置主要是加了有效催化剂。请你根据以上有关数据分析,仅使用催化剂 (填“能”或“否”)消除污染气体。
20.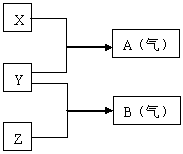 (7分)X、Y、Z为三种不同短周期非金属元素的单质。
(7分)X、Y、Z为三种不同短周期非金属元素的单质。
在一定条件下发生如右图所示反应。
请针对以下两种不同的情况回答:
(1)若常温下X、Y、Z均为气体,
且A和B在化合生成固体C时有白烟产生。则:
①Y的化学式是 ;
②生成固体C的化学方程式是 。
(2)若常温下Y为固体,X、Z为气体,A与B可
按物质的量之比2∶1反应生成Y。则:
①A与B的反应是氧化还原反应,Y是 产物;
②向苛性钠溶液中通入过量的A所发生反应的离子方程式为 ;
③将B与(1)中某单质的水溶液充分反应可生成两种强酸,该反应的化学方程式为
。
19.(10分)请根据要求作答:
(1)按要求写出相关反应的离子方程式:
a.向亚硫酸氢铵溶液中滴加过量的氢氧化钠溶液 ;
b.向溴化亚铁溶液中通入过量的氯气 。
(2)0.3 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,其热化学方程式为 ;
又已知H2O(g)=H2O(l);△H=-44 kJ·mol-1,则0.5 mol乙硼烷完全燃烧生成气态水时放出的热量
是 kJ。
(3)已知在0.1 mol·L-1的NaHSO3溶液中有关微粒浓度由大到小的顺序为:
c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3)
则该溶液中,c(H+) c(OH-)(填“>”、“<”或“=”),简述理由并写出相关的方程式?
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com