
题目列表(包括答案和解析)
(1)决定化学反应速率的主要因素:反应物自身的性质(内因)
(2)外因:
a. 浓度越大,反应速率越快
b. 升高温度(任何反应,无论吸热还是放热),加快反应速率
c. 催化剂一般加快反应速率
d. 有气体参加的反应,增大压强,反应速率加快e. 固体表面积越大,反应速率越快
f. 光、反应物的状态、溶剂等
(1)化学反应速率的概念:
(2)计算
a. 简单计算 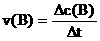
b. 已知物质的量n的变化或者质量m的变化,转化成物质的量浓度c的变化后再求反应速率v
c. 化学反应速率之比 = 化学计量数之比,据此计算:
已知反应方程和某物质表示的反应速率,求另一物质表示的反应速率;
已知反应中各物质表示的反应速率之比或△C之比,求反应方程。
d. 比较不同条件下同一反应的反应速率
关键:找同一参照物,比较同一物质表示的速率(即把其他的物质表示的反应速率转化成同一物质表示的反应速率)
4、发展中的化学电源
(1)干电池(锌锰电池)
a. 负极:Zn -2e - = Zn 2+
b. 参与正极反应的是MnO2和NH4+
(2)充电电池
a. 铅蓄电池:铅蓄电池充电和放电的总化学方程式

放电时电极反应:
负极:Pb + SO42--2e-=PbSO4
正极:PbO2 + 4H+ + SO42- + 2e-= PbSO4 + 2H2O
b. 氢氧燃料电池:它是一种高效、不污染环境的发电装置。它的电极材料一般为活性电极,具有很强的催化活性,如铂电极,活性炭电极等。
总反应:2H2 + O2=2H2O
电极反应为(电解质溶液为KOH溶液)
负极:2H2 + 4OH- - 4e- → 4H2O
正极:O2 + 2H2O + 4e- → 4OH-
化学反应速率与限度
3、金属的电化学腐蚀
(1)不纯的金属(或合金)在电解质溶液中的腐蚀,关键形成了原电池,加速了金属腐蚀
(2)金属腐蚀的防护:
a. 改变金属内部组成结构,可以增强金属耐腐蚀的能力。如:不锈钢。
b. 在金属表面覆盖一层保护层,以断绝金属与外界物质接触,达到耐腐蚀的效果。(油脂、油漆、搪瓷、塑料、电镀金属、氧化成致密的氧化膜)
c. 电化学保护法:牺牲活泼金属保护法,外加电流保护法
2、原电池的设计:根据电池反应设计原电池:(三部分+导线)
A. 负极为失电子的金属(即化合价升高的物质)
B. 正极为比负极不活泼的金属或石墨
C. 电解质溶液含有反应中得电子的阳离子(即化合价降低的物质)
1、原电池:
(1)_概念:(2) 工作原理:
a. 负极:失电子(化合价升高),发生氧化反应
b. 正极:得电子(化合价降低),发生还原反应
(3)原电池的构成条件 :关键是能自发进行的氧化还原反应能形成原电池。
a. 有两种活泼性不同的金属或金属与非金属导体作电极
b. 电极均插入同一电解质溶液
c. 两电极相连(直接或间接)形成闭合回路
(4)原电池正、负极的判断:
a. 负极:电子流出的电极(较活泼的金属),金属化合价升高
b. 正极:电子流入的电极(较不活泼的金属、石墨等):元素化合价降低
(5)金属活泼性的判断:
a. 金属活动性顺序表
b. 原电池的负极(电子流出的电极,质量减少的电极)的金属更活泼 ;
c. 原电池的正极(电子流入的电极,质量不变或增加的电极,冒气泡的电极)为较不活泼金属
(6)原电池的电极反应:a. 负极反应:X-ne=Xn-;b. 正极反应:溶液中的阳离子得电子的还原反应
6、中和热: A. 概念:稀的强酸与强碱发生中和反应生成1mol H2O(液态)时所释放的热量。B、中和热测定实验。
5、常见的吸热反应:
A. 大多数分解反应;
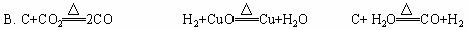
氯化铵与八水合氢氧化钡的反应。
4、常见的放热反应:
A. 所有燃烧反应;B. 中和反应;C. 大多数化合反应;D. 活泼金属跟水或酸反应E. 物质的缓慢氧化
3、化学反应的一大特征:化学反应的过程中总是伴随着能量变化,通常表现为热量变化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com