
题目列表(包括答案和解析)
1.下列实验方法不可用于区别晶体与非晶体的是 ( )
A.用肉眼观察外观是否光亮、透明,且有规则的几何外形B.通过实验看是否有较固定的熔点
C.对固体进行X-射线衍射实验 D.通过实验验证物理性质是否具有各向异性
21.(B)[实验化学]
阿斯匹林(乙酰水杨酸)是由水杨酸和乙酸酐合成的:
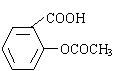
 + (CH3CO)2O
+ (CH3CO)2O 

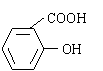
 + CH3COOH
+ CH3COOH
|

在生成乙酰水杨酸的同时,水杨酸分子之间也能发生聚合反应,生成少量聚合物(副产物)。合成乙酰水杨酸的实验步骤如下:
①向150 mL干燥锥形瓶中加入2 g水杨酸、5 mL乙酸酐和5滴浓硫酸,振荡,待其溶解后,控制温度在85℃-90℃条件下反应5-10 min,然后冷却,即有乙酰水杨酸晶体析出。
②减压过滤,用滤液淋洗锥形瓶,直至所有晶体收集到布氏漏斗中。抽滤时用少量冷水洗涤晶体几次,继续抽滤,尽量将溶剂抽干。然后将粗产品转移至表面皿上,在空气中风干。
③将粗产品置于100 mL烧杯中,搅拌并缓慢加入25 mL饱和碳酸氢钠溶液,加完后继续搅拌2-3 min,直到没有二氧化碳气体产生为止。过滤,用5-10 mL蒸馏水洗涤沉淀。合并滤液于烧杯中,不断搅拌,慢慢加入15 mL 4mol / L盐酸,将烧杯置于冰水中冷却,即有晶体析出。抽滤,用冷水洗涤晶体1-2次,再抽干水分,即得产品。
请回答下列问题:
⑴第①步中,要控制温度在85℃-90℃,应采用的加热方法是 ,用这种方法加热需要的玻璃仪器有 。
⑵在第②步中,用冷水洗涤晶体,其目的是 、 。
⑶在第③步中,加入饱和碳酸氢钠溶液的作用是 ,加入盐酸的作用是 。
⑷如何检验产品中是否混有水杨酸? 。
下列两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,请你选择其中一题作答,如果两题全做,则按A题评分。
21.(A)[物质结构与性质]
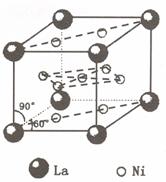
氢是新型清洁能源,但难储运。研究发现,合金可用来储藏氢气。镧(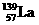 ) 和镍(
) 和镍(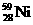 ) 的一种合金就是储氢材料。该合金的晶胞如右图,镍原子除一个在中心外,
) 的一种合金就是储氢材料。该合金的晶胞如右图,镍原子除一个在中心外,
其他都在面上,镧原子在顶点上。储氢时氢原子存在于金属原子之间的空隙中。
(1)一定条件下,该贮氢材料能快速、可逆地存储和释放氢气,若每个晶胞可吸收 3 个 H2, 这一过程用化学方程式表示为: 。
(2)下列关于该贮氢材料及氢气的说法中,正确的是 ( 填序号 )
A.该材料中镧原子和镍原子之间存在化学键,是原子晶体
B.氢分子被吸收时首先要在合金表面解离变成氢原子,同时放出热量
C.该材料贮氢时采用常温高压比采用常温常压更好
D.氢气很难液化是因为虽然其分子内氢键很强,但其分子间作用力很弱
 E.己知镧和镍的第一电离能分别为 5.58eV、7.64eV, 可见气态镧原子比气态镍原子更容易变成+1 价的气态阳离子
E.己知镧和镍的第一电离能分别为 5.58eV、7.64eV, 可见气态镧原子比气态镍原子更容易变成+1 价的气态阳离子
(3)某研究性学习小组查阅的有关镍及其化合物的性质资料如下:
①写出 Ni3+ 的核外电子排布式:
②写出将NiO(OH) 溶于浓盐酸的离子方程式:
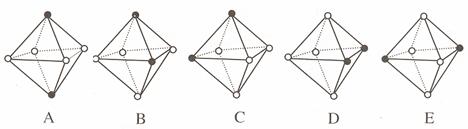
(4)Ni(CO)6为正八面体结构,镍原子位于正八面体的中心,配位体CO在正八面体的六个顶点上。若把其中两个CO配位体换成 NH3 得到新的配合物,则以下物质中互为同分异构体的是 。 ( 填字母编号,任填一组 )( 图中黑点为NH3,圆圈为CO,Ni略去)
(5)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式: 。
20.自然界存在着一种白云石的矿石,其化学式是xCaCO3·yMgCO3。以它为原料,可制取耐火材料等。
(1)称取27.6g白云石,加热到质量不再变化,可以生成耐火材料MgO多少mol?(用x、y的代数式表示)
(2)若在上述反应中,收集到CO26.72L(标准状况下),试写出白云石的化学式(取x、y的最小正整数比)。
 (3)若称取白云石mg,研碎后与过量炭粉混合,放在特定仪器中隔绝空气强热一段时间后,测得白云石分解率为a,生成VL(标准状况)一氧化碳。试计算V为多少L(标准状况)?(用m、a代数式表示)
(3)若称取白云石mg,研碎后与过量炭粉混合,放在特定仪器中隔绝空气强热一段时间后,测得白云石分解率为a,生成VL(标准状况)一氧化碳。试计算V为多少L(标准状况)?(用m、a代数式表示)
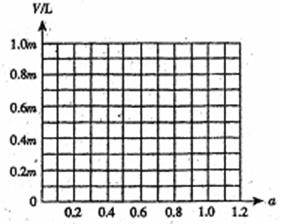 (已知CaO+3C
CaC2+CO;
(已知CaO+3C
CaC2+CO;
2MgO+5C Mg2C3+2CO)
请在下图中画出V和a的关系图。
19.(12分)Ⅰ.某化合物A在一定条件下能发生如下图所示的转变:
其中只有B1既能使溴水褪色,又能与Na2CO3 溶液反应放出CO2 ,回答下列问题:
(1)指出反应类型:X 反应,Y 反应。
(2)物质A的结构简式为 。
(3)写出C1 
 C2的化学方程式
。
C2的化学方程式
。
(4)与F互为同分异构体且核磁共振氢谱只有一种峰的有机物的结构简式有 。

Ⅱ.已知,卤代烃之间能发生反应:
C4H9Cl  (C4H9)2CuLi
(C4H9)2CuLi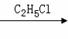 C4H9-C2H5
C4H9-C2H5
聚苯乙烯是一种生活中常见的塑料,试以碳化钙、苯为基本有机原料,无机原料自选,在下列方框中用合成反应流程图合成聚苯乙烯
流程图示例:A 
 B
B
18.(8分)甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为:
CO(g)+2H2(g) CH3OH(g) ΔH
< 0。
CH3OH(g) ΔH
< 0。
Ⅰ.在一定条件下,上述反应在一密闭容器中达到平衡。
(1)体积不变的条件下,下列措施中有利于提高CO的转化率的是 _______(填字母)。
A.升高温度 B.增大压强 C.通入CO D.通入H2
(2)在保证H2浓度不变的情况下,增大容器的体积,平衡____________(填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
作出此判断的理由是________________________
Ⅱ.原料气的加工过程中常常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇和副产物甲烷的碳转化率是不相同的。实验数据见下表:
|
CO2%-CO%-H2% (体积分数) |
0–30–70 |
2–28–70 |
4–26–70 |
8–22–70 |
20–10–70 |
|||||||||||
|
反应温度/℃ |
225 |
235 |
250 |
225 |
235 |
250 |
225 |
235 |
250 |
225 |
235 |
250 |
225 |
235 |
250 |
|
|
碳转化率(%) |
CH3OH |
4.9 |
8.8 |
11.0 |
36.5 |
50.7 |
68.3 |
19.0 |
33.1 |
56.5 |
17.7 |
33.4 |
54.4 |
8.0 |
12.0 |
22.6 |
|
CH4 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
2.8 |
2.8 |
2.8 |
(3)由上表数据可得出多个结论。
结论一:在一定条件下,反应温度越高,碳转化率__________。
结论二:_____________________________________________
(4)为了验证结论二,有科学家又用以下五组不同组成的原料气再次进行实验。
|
组别 |
体积分数(%) |
|||
|
CO |
CO2 |
H2 |
N2 |
|
|
第1组 |
19.7 |
0.0 |
59.1 |
21.2 |
|
第2组 |
20.7 |
0.3 |
62.1 |
16.9 |
|
第3组 |
16.9 |
1.3 |
50.7 |
31.1 |
|
第4组 |
19.8 |
5.5 |
59.4 |
15.3 |
|
第5组 |
20.3 |
10.9 |
60.9 |
7.9 |
进行该验证实验时,控制不变的因素有________________、_________________、____________________________________________等。
17.(10分) (1) 水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(2)随着人类对水的研究的不断深入,水的应用也越来越广泛。研究人员最近发现,在一定的实验条件下,给水施加一个弱电场,在20℃、1个大气压下,水可以结成冰,称为“热冰”。“热冰”有许多实用价值,如开发新药、用于纳米打印机等,还可能用来
(填写序号)
A.代替干冰 B.防止冰川熔化 C.在室温下制作冰雕 D.建室温溜冰场
(3)在灾害性事故中,骨折时有发生,通常用石膏来固定骨折部位。石膏可分为熟石膏(CaSO4·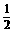 H2O,一种白色粉末)和生石膏(CaSO4·2H2O,一种坚硬的固体)两种,医生使用的石膏是 (填分子式或名称)。石膏定型时发生的化学反应方程式
。
H2O,一种白色粉末)和生石膏(CaSO4·2H2O,一种坚硬的固体)两种,医生使用的石膏是 (填分子式或名称)。石膏定型时发生的化学反应方程式
。
(4)火星探测车在火星大气中检测到了气体A。资料显示,A分子是三原子分子,其相对分子质量为60,在地球环境下A易分解。粉未状的KSCN与浓硫酸在一定条件下可得到气体A和二种硫酸氢盐,,生成物的物质的量之比是1∶1∶1。则气体A的结构式是 。
(5)新型离子化合物[HC60]+[CB11H60Cl60]-是一种功能材料。它可以用超酸H(CB11H60Cl60)和C60反应,使C60得到质子来制取。该反应类型跟中学课本中的一个化学反应类似,课本中的这个反应是(写一个化学方程式) 。
16.(12分)重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:6FeO·Cr2O3
+ 24NaOH +7KClO3 12Na2CrO4
+ 3Fe2O3 +7KCl + 12H2O,
12Na2CrO4
+ 3Fe2O3 +7KCl + 12H2O,
试回答下列问题
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:
。
(2)NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式: 。
(3)操作③的目的是什么,用简要的文字说明: 。
(4)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:
。
(5)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①判断达到滴定终点的依据是: ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品的中重铬酸钾的纯度(设整个过程中其它杂质不参与反应) 。
15.(10分)从含银、铜、金和铂的金属废料中提取金、银、铂的一种工艺如下:
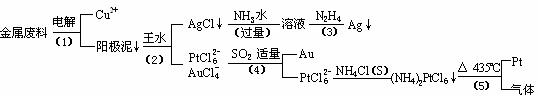
根据以上工艺回答下列问题:
(1)电解时,以金属废料为阳极,纯铜为阴极,CuSO4溶液为电解液,写出电解反应的阳极方程式: :
(2)写出步骤(4)的离子反应方程式:
;
(3)金和浓硝酸反应的化学方程式为:Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O
但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之: 。
(4)我们知道,稀盐酸与铜不反应。在稀盐酸中加入H2O2等氧化剂后,则可使铜顺利溶解。某同学未加入氧化剂,而是设计了一个实验装置,也能使铜溶于稀盐酸。请在方格中画出该装置:
(5)分别将等质量的铜片与分别等体积、过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈绿色,后者呈兰色,甲同学提出可能是Cu2+浓度不同引起的,乙同学提出溶液呈“绿色”是溶液中Cu2+与NO2共存的结果,请你设计实验探究甲乙两同学的说法谁更正确(简述实验方案和实验现象及由此得出的结论:
14.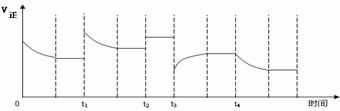 合成氨反应:N2(g)
+ 3H2(g)
合成氨反应:N2(g)
+ 3H2(g)  2NH3(g) △H=-92.4kJ·mol-1,在反应过程中,正反应速率的变化如下图:
2NH3(g) △H=-92.4kJ·mol-1,在反应过程中,正反应速率的变化如下图:
下列说法正确的是
A.t1时升高了温度
B.t2时使用了催化剂
C.t3时减小了压强
D.t4时降低了温度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com