
题目列表(包括答案和解析)
1.钛(Ti)金属常被称为未来钢铁。钛元素的同位素46 22Ti、47 22Ti、48 22Ti、49 22Ti、50 22Ti中,中子数不可能为 ( )
A.28 B.30 C.26 D.24
3.位置与性质关系:同位置--化学性质相同,同主族--相似性、递变性;同周期--相似性、递变性。
 [典型例题]
[典型例题]
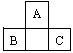
[例1]A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍,则A、B、C的元素符号分别:A__________、B______、C_______。A的原子结构示意图为_________,B在周期表中的位置______,C的离子结构示意图为________,A的氢化物分子式为_________;B、C的最高价氧化物水化物的分子式分别为_______、_________,它们的酸性_______比________强。
[例2]X和Y的原子序数都小于18,两者都能组合化合物X2Y3,已知X的原子序数为n,则Y的原子序数不可能是:
A、n+11 B、n-5 C、n+3 D、n-6
[例3]下表是元素周期表的一部分,回答下列有关问题:
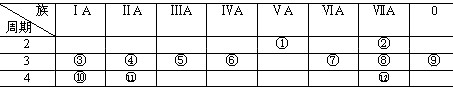
⑴写出下列元素符号:① ,⑥ ,⑦ , 11 。
⑵在这些元素中,最活泼的金属元素是 ,最活泼的非金属元素是 ,最不活泼的元素是 。
⑶在这些元素的最高价氧化物对应水化物中,酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 ,写出三者之间相互反应的化学方程式:
⑷在这些元素中,原子半径最小的是 ,原子半径最大的是 。
⑸在③与④中,化学性质较活泼的是 ,怎样用化学实验证明?
⑹在⑧与 12 中,化学性质较活泼的是 ,怎样用化学实验证明?
[课后巩固]
2.结构与性质关系:电子层结构与原子半径、离子半径、电子得失难易、化合价的关系
1.位置与结构关系:原子序数=质子数;周期数=电子层数;主族序数=最外层电子数
2.同主族从上到下:元素金属性增强,非金属性减弱,对应的单质与酸或水置换出氢由难到易,气态氢化物稳定性减弱,最高价氧化物对应的水化物碱性增强,酸性减弱。
1.同周期从左到右(稀有气体除外):元素金属性逐渐 ,非金属性逐渐 ,对应的单质与酸或水置换出氢 ;最高价氧化物的水化物的酸性 ,碱性 ;对应气态氢化物的稳定性 。
3.元素主要化合价的周期性变化规律
①同周期元素,随着原子序数的递增,元素主要化合价呈现周期性变化
②对于主族元素:最高正化合价=主族族序数=最外层电子数(O、F除外)
最低负化合价=最外层电子数-8(H及无负价元素除外)
最高正化合价+|最低负化合价|=8(H、O、F除外)
2.元素的原子半径的周期性变化规律
①同周期元素原子半径随着原子序数的递增而 (稀有气体除外)
②同主族元素原子半径随着原子序数的递增而
③原子半径的比较:同周期:原子序数越大,原子半径 (稀有气体除外)
同主族:原子序数越大,原子半径
④离子半径的比较:核外电子排布相同时,原子序数越大,离子半径
核外电子排布不相同时(均为稳定结构),电子层数越多,半径
1.含义:元素的性质随着元素核电荷数的递增呈周期性的变化规律叫元素周期律
2.族:①由 构成的族,叫做主族; 构成的族,叫做副族。②元素周期表的中部从 族到 族10个纵行,包括了 族和全部副族元素,共六十多种元素,通称为过渡元素。因为这些元素都是 ,所以又把它们叫做过渡金属。③主族元素的族序数=元素原子的最外层电子数。周期表共18个纵行( 个主族; 个副族;一个 族;一个 族( 、 、 三个纵行))。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com