
题目列表(包括答案和解析)
3、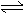 右图表示可逆反应A(g)+B(g) nC(g) ΔH<0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线,有关叙述一定正确的是( )
右图表示可逆反应A(g)+B(g) nC(g) ΔH<0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线,有关叙述一定正确的是( )
 (A)a表示有催化剂,而b无催化剂
(A)a表示有催化剂,而b无催化剂
(B)若其他条件相同,a比b的温度高
(C)若其他条件相同,a比b的压强大,n>2
(D)反应由逆反应方向开始
2、 在体积、温度都相同的条件下有如下反应:2A(气)+2B(气) C(气)+3D(气)。现分别从两条途径建立平衡:(Ⅰ)A、B的起始物质的量均为2mol;(Ⅱ)C、D的起始物质的量分别为2mol和6mol。以下叙述正确的是( )
在体积、温度都相同的条件下有如下反应:2A(气)+2B(气) C(气)+3D(气)。现分别从两条途径建立平衡:(Ⅰ)A、B的起始物质的量均为2mol;(Ⅱ)C、D的起始物质的量分别为2mol和6mol。以下叙述正确的是( )
(A)Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成相同
(B)Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成不同
(C)达到平衡时,Ⅰ途径的反应速率vA等于Ⅱ途径的反应速率vD
(D)达到平衡时,Ⅰ途径所得混合气体的密度为Ⅱ途径所得混合气体密度的1/2
1、 可逆反应:2NO2 2NO+O2在定容密闭容器中反应,达到平衡状态的标志是( )
可逆反应:2NO2 2NO+O2在定容密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时生成2 nmolNO2
②单位时间内生成n molO2的同时生成2 nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
(A)①④⑥ (B)②③⑤ (C)①③④ (D)①②③④⑤⑥
3、常温下,某溶液中由水电离产生的c[H+]、C(OH-)满足c(H+)·c(OH+)=10-24,则下各
离子在该溶液中一定可以大量共存的是( )
A.K+ Na+ AlO2- Cl- B.Na+ Cl- SO42- HCO3-
C.NH4+ Na+ NO3- SO42- D.Ba2+ Na+ Cl- NO3-
2、下列各种溶液中,能大量共存的无色透明的离子组( )
A.使PH=0的溶液: Fe2+ 、NO3-、SO42-、I-
B.C(H+)=10-14mol· L-1的溶液中:Na+ 、AlO2-、S2-、SO32-
C.酸性环境下:Na+ 、 Cu2+ 、NO3-、SO42-、
D.使紫色石蕊试液变红的溶液中:K+ 、Na+ 、Ca2+ 、HCO3-
1、在下述条件下,一定能大量共存的离子组是( )
A.无色透明的水溶液中:K+、Mg2+、I-、MnO4-
B.pH=1的NaNO3水溶液中:NH4+、Fe2+、SO42-、Cl-
C.c(HCO3-)=0.1mol/L的溶液中:Na+、K+、CO32-、Br-
D.由水电离产生的c(OH-)=1×10-14mol/L的溶液中:H+、Al3+、Cl-、NO3-
4、下列离子方程式正确的是( )
A.向碘化亚铁溶液中通入少量氯气 2Fe2++Cl2=2Fe3++2Cl-
B.向次氯酸钙溶液中通入过量二氧化硫 Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C.向硫酸氢钠溶液中滴入氢氧化钠溶液至中性 H++SO +Ba2++OH-=BaSO4↓+H2O
+Ba2++OH-=BaSO4↓+H2O
D.将氢氧化铁粉末加入氢碘酸中 Fe(OH)3+3H=Fe3++3H2O
3、下列离子方程式错误的是( )
(A)将少量SO2气体通入NaClO溶液中
SO2+2ClO-+H2O==SO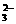 +2HClO
+2HClO
(B)在硫酸氢钾溶液中加入Ba(OH)2溶液至pH=7
2H++SO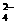 +Ba2++2OH-==BaSO4↓+2H2O
+Ba2++2OH-==BaSO4↓+2H2O
(C)小苏打溶液和甲酸混合
HCO +HCOOH
= HCOO-+CO2↑+H2O
+HCOOH
= HCOO-+CO2↑+H2O
(D)澄清石灰水与少量小苏打溶液混合:Ca2+十OH-+HCO ==CaCO3↓+H2O
==CaCO3↓+H2O
2、下列反应的离子方程式正确的是( )
(A)金属钠跟水反应:Na+2H2O=Na++2OH-+H2↑
(B)在漂白粉溶液中通入过量SO2 :ClO¯+SO2+H2O=HSO3━+HClO

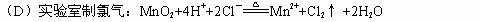
1、下列离子方程式正确的是( )
A.等物质的量的Ba(OH)2与明矾溶液混合:
3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓
B.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
C.H218O中投入Na2O2固体:2H218O+2O22-=4OH-+18O2↑
D.CuCl2溶液中加入NaHS溶液:Cu2++2HS-+2H2O=Cu(OH)2↓+2H2S↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com