
题目列表(包括答案和解析)
(可能用到相对原子质量:H-1 C-12 O-16 Cl-35.5 Ca-40)
1. 组装仪器__________
2. 准称D装置为M1克
3. 准称样品混合物的质量n克放也入B内
4. _________,使稀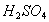 缓缓滴在样品上,直至不再产生气泡
5. 向A中鼓入空气,要缓缓进气几分钟后,再称___________(仪品名称)的总质量为
缓缓滴在样品上,直至不再产生气泡
5. 向A中鼓入空气,要缓缓进气几分钟后,再称___________(仪品名称)的总质量为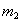 克)
请你(1)将步骤中缺处补充完整,回答(2)鼓入空气目的是_________ A,应盛_______溶液(俗称),用作________________(3)步骤4、5操作要慢,缓其目的是______________,过快,导致实验值_________(偏大或小)(4)E作用____________(5)由记录数据处理,含有纯碱的质量分数为_________(6)夹子K在________操作后打开
解析:(1)读审题目,明确用测定
克)
请你(1)将步骤中缺处补充完整,回答(2)鼓入空气目的是_________ A,应盛_______溶液(俗称),用作________________(3)步骤4、5操作要慢,缓其目的是______________,过快,导致实验值_________(偏大或小)(4)E作用____________(5)由记录数据处理,含有纯碱的质量分数为_________(6)夹子K在________操作后打开
解析:(1)读审题目,明确用测定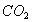 含量导出纯碱质量。一定要保证产物
含量导出纯碱质量。一定要保证产物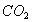 纯且产生,吸收都充分
(1)检查气密性 ;打开分液漏斗a ;干燥管D 。(2)使产生的
纯且产生,吸收都充分
(1)检查气密性 ;打开分液漏斗a ;干燥管D 。(2)使产生的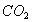 全部通过D被吸收A中盛大碱溶液吸收空气中
全部通过D被吸收A中盛大碱溶液吸收空气中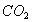 (3)在B中
(3)在B中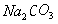 反应充分,
反应充分,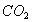 气流通过碱石灰被吸收彻底,过快使测定结果偏低
(4)防止空气中
气流通过碱石灰被吸收彻底,过快使测定结果偏低
(4)防止空气中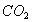 进入D。 (5)
进入D。 (5)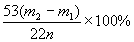 (6)操作 4 后打开K夹鼓入空气
(6)操作 4 后打开K夹鼓入空气
★1为确定气体X(可能为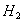 、CO 、
、CO 、 的一种),将X点燃,将其产生通过A、B两个洗气瓶,无明显现象,B中溶夜可使酚酞变红
试回答:(1)A中盛有______溶液 ,B中液体应为______
(2)填下表 √表示增加 ×表示不变
的一种),将X点燃,将其产生通过A、B两个洗气瓶,无明显现象,B中溶夜可使酚酞变红
试回答:(1)A中盛有______溶液 ,B中液体应为______
(2)填下表 √表示增加 ×表示不变
|
A 质 量 |
√ |
× |
√ |
|
B 质 量 |
× |
√ |
√ |
|
X 化 学 式 |
① |
② |
③ |
|
燃烧方程式 |
|
|
|
(3)若X为纯净或混合物,当AB质量均增加时,X组成最多为______种,X为纯净物时,若B增m克A则增加_______克
★★★2 、可选用装置(如下示意图铁架台未画)
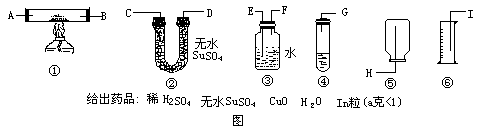
给出药品:稀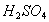 ,无水
,无水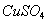 、
、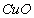 、
、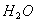 、
、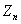 粒(a克<1)
利用以上条件,设计最简单实验,粗测锌原子相对质量。(假定标况下实验
粒(a克<1)
利用以上条件,设计最简单实验,粗测锌原子相对质量。(假定标况下实验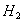 密度 0.08928g/l)
(1)选用装置按顺序为(写装置标号)_________
各仪器接口连接顺序为(写接口字母)_________
(2)为
密度 0.08928g/l)
(1)选用装置按顺序为(写装置标号)_________
各仪器接口连接顺序为(写接口字母)_________
(2)为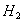 产量尽量少损失,放试剂时操作为_________
(3)测得水为V升,所用
产量尽量少损失,放试剂时操作为_________
(3)测得水为V升,所用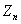 粒a克,则
粒a克,则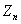 原子量数学表达式为________
★★★3、有气体
原子量数学表达式为________
★★★3、有气体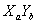 为测定其组成,做如下图所示实验
为测定其组成,做如下图所示实验
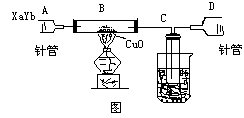
将欲测气(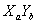 )由注射器A缓缓推入B管,至B内反应完全,由黑变红。
数据:B管与药品反应前后质量分别为21.32克和21.16克。
测定:C管内收集到的物质电解后是
)由注射器A缓缓推入B管,至B内反应完全,由黑变红。
数据:B管与药品反应前后质量分别为21.32克和21.16克。
测定:C管内收集到的物质电解后是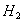 和
和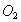 ,D针管中收集到
,D针管中收集到 己知:被测气体中,元素质量比为14 : 3
试回答(1)C中收集到的液体为 ________ 克
(2)B中反应化学方程式为________
己知:被测气体中,元素质量比为14 : 3
试回答(1)C中收集到的液体为 ________ 克
(2)B中反应化学方程式为________
1、读审题中信息,联系学过的知识,紧扣实验目的,创设途径选择最佳。
2、分解每一步骤,明确这一步目的,严格准确操作(如气体的投制,净化,干燥各步)
3、审定系统顺序使整个流程谐调(如先查气密后制气,先去杂后干燥;用洗气瓶,长管进短管出…)
例1、例用下图给出装置,设计实验以粗略测定铜的相对原子量(已知氢、氧原子的相对质量)回答提出问题。
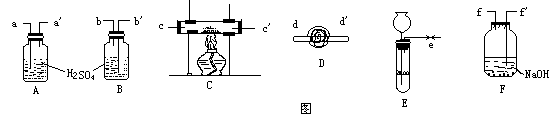
(1)按气流从左至右流向,仪器组装连接顺序为(用大写字母标)______________ (2)各组仪器接口顺序为(用小写字母标)____________
(3)写出下列装置的作用A ___________B_____________F____________
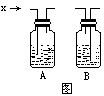
解析:1.读、审题目,实验目的:粗测铜的原子相对质量,由给出的图示,可进行氢气还原氧化铜实验,能测生成水的量,则可达目的。因是计量实验,要尽量使实验值准确,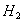 要净化干燥、产物水量要防止其它湿气的干扰。
2.分解审定;参照图示,
要净化干燥、产物水量要防止其它湿气的干扰。
2.分解审定;参照图示,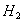 除HCl用F,干燥用A;测定水量D紧接C,防止大气中湿气干扰后接B。接口位置注意,洗气瓶导管,长进短出,干燥管粗进细出。
答案:(1)E→F→A→C→D→B
(2)e→f’, f→a , a’→c , c’→d’ , d’→b’
3)A干燥
除HCl用F,干燥用A;测定水量D紧接C,防止大气中湿气干扰后接B。接口位置注意,洗气瓶导管,长进短出,干燥管粗进细出。
答案:(1)E→F→A→C→D→B
(2)e→f’, f→a , a’→c , c’→d’ , d’→b’
3)A干燥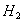 ,B吸收大气口水气 F吸收
,B吸收大气口水气 F吸收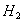 中混有的HCl
例2、已知某食盐中掺有纯碱。为测定纯碱含量,按下图装置进行实验:
中混有的HCl
例2、已知某食盐中掺有纯碱。为测定纯碱含量,按下图装置进行实验:
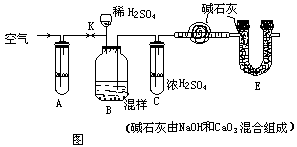
实验步骤:
1、熟练掌握各基本实验操作技能(制气分 型,
型, 型,集气有排水法,排空气法,干燥,净化…)
2、培养审准实验目的,审定全系统步骤先后顺序合理,以达目的的能力
[要点讲解]
型,集气有排水法,排空气法,干燥,净化…)
2、培养审准实验目的,审定全系统步骤先后顺序合理,以达目的的能力
[要点讲解]
5.称取氯化钠和氯化钙的固体混合物14g,放入烧杯中,加入96g碳酸钠溶液恰好完全反应(反应的化学方程式为:Na2CO3 + CaCl2 = CaCO3↓+ 2 NaCl)。待反应完全后过滤,称得滤液的总质量为100g。
(1)根据质量守恒定律,可知生成的沉淀质量为 。
(2)固体混合物中氯化钙的质量是多少?
(3)所得滤液中溶质的质量分数是多少?
4.t℃时,将210gKNO3溶液蒸发20g水后析出4g晶体;若将210g溶液蒸发掉24g水后,析出6g晶体,则原KNO3溶液中溶质的质量是多少?
3.在化学反应A + 2B=C + 3 D中,2g A与4.1g B完全反应,生成5.6 g C。当有1.5g D生成时,参加反应的A的质量是( )
A.6g B.5.6g C.4.5g D.0.5g
2. 在天平两端各放一个盛有等质量等质量分数的稀硫酸的烧杯,调天平至平衡,若分别投入镁粉和铁粉,且全部溶解,天平仍保持平衡,则投入镁粉和铁粉的质量比为:
A.3∶7 B.7∶3 C. 77∶81 D. 81∶77
1. 现有铁,锌,镁,铝四种金属分别与足量的稀硫酸反应,当生成氢气质量相等时,所消耗金属质量最小的是:( )
A.铁 B. 锌 C. 镁 D. 铝
3.25℃恒温条件下,将固体物质A的溶液200g蒸发20g水后,析出10gA;再蒸发20g水,又析出20gA,则蒸发前的溶液中溶质的质量分数是多少?
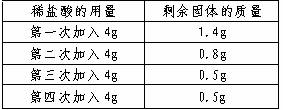 例3.有一种只含SiO2杂质(SiO2不溶于水,也不与盐酸反应)的石灰石样品。某学生想测定该样品中碳酸钙的质量分数,他取用2g样品,把16g稀盐酸平均分4次加入,充分反应后剩余固体的质量依次记录于下表:
例3.有一种只含SiO2杂质(SiO2不溶于水,也不与盐酸反应)的石灰石样品。某学生想测定该样品中碳酸钙的质量分数,他取用2g样品,把16g稀盐酸平均分4次加入,充分反应后剩余固体的质量依次记录于下表:
计算:(1)样品中碳酸钙的质量分数。
(2)2g样品与稀盐酸充分反应时,恰好用去稀盐酸的质量为多少克?此时,所得溶液溶质的质量分数为多少?(小数点后保留两位数字)
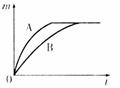 巩固练习:
巩固练习:
用相同质量的铁和锌跟一定量的稀硫酸反应,其反应过程如下图所示(图中横、纵坐标分别表示反应的时间t和产生氢气的质量m)。试回答:
(1)曲线A表示的是(填“铁”或“锌”)跟稀硫酸反应的情况 ______________ ;
(2)上述曲线图除能说明(1)的结论外,还可以得出另外两个结论,它们是_________,_____。
拓展提高:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com