
题目列表(包括答案和解析)
2.氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300-1700oC的氮气流中反应制得3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)上述反应氧化剂是 ,已知该反应每转移1mole-,放出132.6kJ
的热量,该方程式的∆H = 。
(2)能判断该反应(在体积不变的密闭容器中进行)已经达到平衡状态的是( )
A.焦炭的质量不再变化 B.N2 和CO速率之比为1:3
C.生成6molCO同时消耗1mol Si3N4 D.混合气体的密度不再变化
(3)下列措施中可以促进平衡右移的是 ( )
A.升高温度 B.降低压强
C.加入更多的SiO2 D.充入N2
(4)该反应的温度控制在1300-1700oC的原因是 。
(5)某温度下,测得该反应中N2和CO各个时刻的浓度如下,求0-20 min内N2的平
均反应速率 ,该温度下,反应的平衡常数K= 。
|
时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
|
N2浓度/mol·L-1 |
4.00 |
3.70 |
3.50 |
3.36 |
3.26 |
3.18 |
3.10 |
3.00 |
3.00 |
3.00 |
|
CO浓度/mol·L-1 |
0.00 |
0.90 |
1.50 |
1.92 |
2.22 |
2.46 |
2.70 |
- |
- |
- |
1.(1)已知:
Fe(s)+1/2O2(g)=FeO(s) 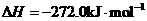
2Al(s)+3/2O2(g)= Al2O3(s) 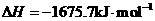
Al和FeO发生铝热反应的热化学方程式是
_____________________________________________________。
(2) 1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g) 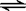 Na2S(s) + 4H2O(g) 。
Na2S(s) + 4H2O(g) 。
①该反应的平衡常数表达式为____________________。已知K1000℃<K1200℃,则该反应是________反应(填“吸热”或“放热”)。
②用有关离子方程式说明上述反应所得固体产物的水溶液的酸碱性_________________。
(3)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8,请回答下列问题:
①混合溶液中水电离出的c(H+)与0.1mol·L-1NaOH溶液中水电离出的c(H+)比较
(填<、>、=)。
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填<、>、=);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为 。(填序号)
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
9、答案:实验I:(1)bc;(2分)(2)3mol/LH2SO4、氯化钠固体(或6mol/LHCl、硫酸钠固体)(2分)
实验II:大于(2分)(1)2Al+Fe2O3 2Fe + Al2O3;(3分)
2Fe + Al2O3;(3分)
(2)①2(1分);②1(1分);
(3)3(1分),2Al+2OH-+2H2O=2AlO2-+3H2↑;(3分);
[解析]实验I:(1)两实验现象的差异原因应从反应物组成的不同点去寻找,此题中其他条件均相同,不同的是盐酸中含有Cl-而硫酸中含有SO42-,所以从这个方面思考即可得答案;
(2)根据控制变量法和对比实验法,在控制其他条件相同时,只让两实验中有一个变量不同。如:都用稀硫酸,但其中一份加入Cl-而另一份不加Cl-,即可得出结论(类似方法亦可)。
实验II:由化学方程式可知,等物质的量的HCl与NaOH相比,NaOH消耗的铝更多,所以留下的铝就少,故“前者大于后者”;
(1)根据信息和有关物质的性质,可以看出黑色固体可能是铝、铁、硅三种单质中的一种或几种,从而提出猜想。猜想1中铁的生成是由于电解法时生成的铝能与氧化铁发生铝热反应,由此可写出相应的化学反应方程式;猜想2的化学反应方程式根据题意就可直接写出;
(2)①在盐酸中固体完全溶解,证明一定不含硅,所以猜想2一定不正确;
②在氢氧化钠溶液中固体完全溶解,证明一定不含铁,所以猜想1一定不正确;
(3)综合(1)(2)中相应的结论,可知此固体只含有铝,故猜想3正确,猜想4不正确,固体是铝,铝与氢氧化钠溶液反应的离子方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑。
8、答案:(13分)(1)容量瓶(2分)(2)干燥氯气(1分)
(3)Cl2 + 2OH- = Cl- + ClO- + H2O(2分)
(4)HCl溶于水电离出的H+和饱和NaCl溶液中的Cl- 都会对反应Cl2
+ H2O 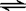 H+ + Cl-+ HClO 起到抑制作用(2分)
H+ + Cl-+ HClO 起到抑制作用(2分)
(5)不合理;实验进行中Cl2与湿润红色纸条中的水反应生成HClO使湿润的红色纸条褪色,干燥部分没有HClO,所以纸条不褪色,放置一段时间,由于水分子运动会导致整个纸条湿润而褪色。(2分)
取一塑料板将干燥的红色纸条和湿润的红色纸条分别贴在塑料板两侧,将该装置放入装置D中。或将氯气先通入装有干燥的红色纸条的试管,再通入装有湿润的红色纸条的试管中。(2分,合理给分)
(6)0.5(2分)
7、答案:(共14分,每空2分)
(1) CaCO3+2H+=Ca2++CO2↑+H2O;吸收从B装置中的试管内逸出的氨气,减少对环境的污染
(2)温度越低,碳酸氢钠的溶解度越小,便于析出
(3)A与B; 饱和NaHCO3溶液(其他合理答案均可给分);除去CO2中混合的HCl气体
(4)60%
6、答案:(15分)(1)(1分) ① (2)(1分) 蒸发皿
(3)(4分)A接 G , F 接 H ; B接___D __,___E _接___ C _
(4)(2分) Cl2+ 2OH - ==Cl - +ClO - +H2O
(5)(4分)2Cl - + 2H2O  2OH - + Cl2↑+ H2↑ pH约为12
2OH - + Cl2↑+ H2↑ pH约为12
(6)(3分)量筒中液面和广口瓶液面相平;读数时视线与量筒凹液面相平;待整套装置恢复至室温时再行读取数据。
5、答案:(共14分)
|
⑵ C + 2H2SO4(浓) = CO2↑ + 2SO2↑ + 2H2O(2分,“条件”或“↑”未标扣1分)
⑶ 品红溶液褪色(2分,或“颜色变浅”) 除尽反应产物中的SO2气体(2分)
⑷ (11m-3b)/11m
⑸ 装置内的CO2难以赶尽,导致E质量增重偏小
⑹ SO2不一定能全部被品红、KMnO4除去或E中碱石灰会吸收空气中的CO2、H2O(其它合理的也得分)
4、答案:(14分)⑴CO2、CO的混合物(2分)
⑶NH4++NO2- N2↑+2H2O(3分)
N2↑+2H2O(3分)
⑷步骤②中是为了排尽空气(1分)步骤④是为了赶出所有的CO2,确保完全吸收(1分)
⑸2C+Fe2O3 2Fe+CO↑+CO2↑(3分)
2Fe+CO↑+CO2↑(3分)
⑹①Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全;M (BaCO3)>M(CaCO3),称量时相对误差小。(2分)
②在尾气出口处加一点燃的酒精灯或增加一尾气处理装置(2分)
[命题立意]考查化学实验综合能力,物质制备的反应原理,试剂的作用,实验装置的优化及学生环保意识的培养,同时对实验中的定量问题进行考查。
3、答案:⑴检验装置气密性 (2分) ⑵SO2 (1分) 防倒吸(2分)
⑶Cu+2H2SO4 CuSO4+SO2↑+2H2O ( 2分) 长导管(2分)
CuSO4+SO2↑+2H2O ( 2分) 长导管(2分)
⑷过滤、洗涤、干燥 (各1分) 12mol/L ( 2分)
⑸需要加双氧水( 1分) 原因:在烧杯中生成的Na2SO3可能被部分氧化为Na2SO4,如果不加入双氧水而直接测定沉淀质量则无法确定S元素的物质的量,从而使实验结果错误。(2分)
2、答案:(共13分)
(1)B(2分)
(2)(2分)
(3)将C中的溶液加适量水稀释(2分)
(4)第二,打开a,通足量N2,排净装置中的空气(2分)
(5)向下移动乙管,使甲、乙两管液面在同一水平面上(2分) (6)(V-11.2n)/33.6n (3分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com