
题目列表(包括答案和解析)
14.用含少量铁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是( )
①加盐酸溶解;②加烧碱溶液溶解;③过滤;④通入过量CO2生成Al(OH)3沉淀;⑤加入盐酸生成Al(OH)3沉淀; ⑥加入过量烧碱溶液.
A.①⑥⑤③ B.②③⑤③
C.②③④③ D.①③⑤③
解析:加烧碱溶液溶解后,过滤可以除去铁粉,得到偏铝酸钠溶液,再通入过量CO2过滤后,可得Al(OH)3沉淀.不易用盐酸的原因是Al(OH)3沉淀可溶于盐酸,不易控制用量.
答案:C
13.(2010·扬州模拟)芳香族化合物A的 分子式为C7H6O2,将它与NaHCO3溶液混合加热,有酸性气体产生.那么包括A在内,属于芳香族化合物的同分异构体的数目是( )
分子式为C7H6O2,将它与NaHCO3溶液混合加热,有酸性气体产生.那么包括A在内,属于芳香族化合物的同分异构体的数目是( )
A.5 B.4
C.3 D.2
解析:分别是:苯甲酸、甲酸苯酚酯、羟基苯甲醛(包括邻、间、对三种).
答案:A
12.某同学对未知物A盐的水溶液进行了鉴定,实验过程及现象如图所示:
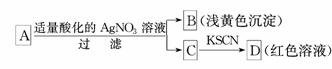
现对A、B、C、D作出的如下推断中,不正确的是( )
A.盐A一定是FeBr3
B.浅黄色沉淀B是AgBr
C.滤液C中一定含Fe3+
D.D溶液中有[Fe(SCN)]2+
解析:盐A也可能是FeBr2,因为亚铁离子与硝酸酸化的AgNO3溶液反应转化为铁离子.
答案:A
11.(2010·东城模拟)为预防“H1N1”甲型流感,同学们每天用“84”消毒液(NaClO溶液)消毒,下列说法正确的是( )
A.NaClO溶液的消毒原理是使蛋白质变性
B.1 mol Cl2与足量NaOH溶液反应转移2 mol电子
C.NaClO溶液的漂白原理与Na2O2、SO2相同
D.“84”消毒液与“洁厕灵”(盐酸)共同使用,可达到既清洁又消毒的双重效果
解析:NaClO是强氧化剂,可使蛋白质变性;1 mol Cl2与足量NaOH溶液反应转移1 mol电子;NaClO溶液的漂白原理与SO2不同;“84”消毒液与“洁厕灵”(盐酸)能发生反应:ClO-+Cl-+2H+===Cl2↑+H2O,放出的氯气可使人中毒.
答案:A
10.在下列溶液中通入SO2气体,能发生氧化还原反应而使溶液褪色的是( )
A.品红溶液 B.显红色的酚酞溶液
C.酸性KMnO4溶液 D.硫酸铜溶液
解析:SO2使品红溶液褪色是由于发生了化合反应,显红色的酚酞溶液褪色是利用了H2SO3的酸性,以上两个反应均是非氧化还原反应.SO2与硫酸铜不反应,溶液不褪色.SO2可与酸性KMnO4溶液发生氧化还原反应而使之褪色.
答案:C
9.将1.12 g铁粉加入25 mL 2 mol/L的FeCl3溶液中,充分发生反应后,其结果是( )
A.往溶液中滴入无色的KSCN溶液,不显红色
B.Fe2+和Fe3+的物质的量比为6∶1
C.反应中氧化产物和还原产物的物质的量比为2∶1
D.铁粉有剩余,溶液浅绿色,Cl-的浓度基本保持不变
解析:0.02 mol Fe与0.05 mol FeCl3反应生成0.06 mol Fe2+、剩余0.01 mol Fe3+.
答案:B
8.(2010·河西区模拟)下列离子方程式书写错误的是( )
A.H2O2和酸性氯化亚铁溶液反应:2Fe2++H2O2+2H+===2Fe3++2H2O
B.氯气和二氧化硫等物质的量通入水中的离子方程式:
Cl2+SO2+2H2O===4H++SO++2Cl-
C.向硫酸氢钠溶液中逐滴加入氢氧化钡溶液,至SO沉淀完全H++SO+Ba2++OH-===BaSO4↓+H2O
D.将SO2通入Ca(ClO)2溶液中:Ca2++2ClO-+SO2+H2O===CaSO3+2HClO
解析:SO2与水反应生成亚硫酸,ClO-在酸性溶液中有强氧化性,二者会发生氧化还原反应.
答案:D
7.一定温度下,W g下列物质在足量氧气中充分燃烧,产物与过量的过氧化钠完全反应,过氧化钠固体增重W g,符合此要求的是( )
①H2;②CO;③CO和H2;④C2H4O2;⑤C2H2O4
A.全部 B.仅④⑤
C.除⑤以外 D.除④以外
解析:只要是H2、CO、或CO和H2或分子拆开后相当于CO和H2 都符合题意,④可以拆成2CO、2H2符合题意,⑤不符合题意.
答案:C
6.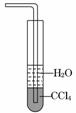 (2010·巢湖模拟)下列关于氨气的说法正确的是( )
(2010·巢湖模拟)下列关于氨气的说法正确的是( )
A.氨气可以用浓硫酸干燥也可用碱石灰干燥
B.氨水能导电,所以NH3是电解质
C.稳定性:NH3<CH4
D.用水吸收NH3用右图装置可防止倒吸
解析:氨气不可用浓硫酸干燥;NH3是非电解质;N元素的非金属性大于C元素,根据周期律可知,稳定性:NH3>CH4.
答案:D
5.一种酸性较强的溶液中,可能存在NO、I-、Cl-和Fe3+中的一种或几种,向该溶液中加入溴水后,溴单质被还原,由此可推知这种溶液中( )
A.含I-,不能确定是否含Cl-
B.含NO
C.含I-、NO、Cl-
D.含Fe3+
解析:能够还原溴单质只有I-,则在酸性较强的溶液中一定不含NO和Fe3+,可能含有Cl-.
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com