
题目列表(包括答案和解析)
13.一定质量的液态化合物XY2,在标准状况下的一定质量的O2中恰好完全燃烧,反应方程式为:XY2(l)+3O2(g)===XO2(g)+2YO2(g),冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56 g·L-1,则:
(1)反应前O2的体积是________。
(2)化合物XY2的摩尔质量是________。
(3)若XY2分子中X、Y两元素的质量比是3∶16,则X、Y两元素分别为________和________(写元素符号)。
[解析] (1)由反应XY2(l)+3O2(g)===XO2(g)+2YO2(g)可知,反应前后气体的体积变化为0,故V(O2)=672 mL。
(2)由m=ρV,生成物的质量m=0.672 L×2.56 g·L-1=1.72 g,
XY2 + 3O2(g)===XO2+2YO2,
12.化合物A是一种不稳定的物质,它的分子组成可用OxFy表示。10 mL A气体能分解生成15 mL O2和10 mL F2(同温、同压)。
(1)A的化学式是________,推断依据是______________________________。
(2)已知A分子中x个氧原子呈…O-O-O…链状排列,则A分子的电子式是______________________,A分子的结构式是______________。
[解析] OxFy―→O2 + F2
10 mL 15 mL 10 mL
分子数比 2 3 2
再由质量守恒定律得x=3,y=2。
[答案] (1)O3F2 阿伏加德罗定律、质量守恒定律
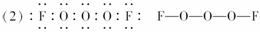
11.超导体是具有零电阻及反磁性的物质,以Y2O3、BaCO3及CuO为原料,经研细烧结可合成一高温超导物质YBa2Cu3Ox。现欲合成0.5 mol此高温超导体,依化学剂量比例需要Y2O3______mol,CuO______mol。
[解析] 运用反应前后原子守恒。0.5 mol YBa2Cu3Ox中含Y 0.5 mol,含Cu 0.5 mol×3=1.5 mol,则需Y2O3 0.25 mol,CuO 1.5 mol。
[答案] 0.25 1.5
10.设NA为阿伏加德罗常数的值,下列叙述中正确的是 ( )
A.46 g NO2和N2O4混合气体中含有原子数为3NA
B.标准状况下22.4 L H2中含中子数为2NA
C.1 L 1 mol/L醋酸溶液中离子总数为2NA
D.1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子
[解析] 等质量的NO2和N2O4,含有相同数目的原子,故A正确;普通H2不含中子,故B错误;醋酸是弱酸,不完全电离,1 L 1 mol/L醋酸溶液电离出的醋酸根离子和氢离子之和小于2NA,故C错误;Mg-2e-===Mg2+,故D正确。
[答案] AD
9.在273 K和101 kPa的条件下,将2.00 g氦气、1.40 g氮气和1.60 g氧气混合,该混合气体的体积是 ( )
A.6.72 L B.7.84 L
C.10.08 L D.13.44 L
[解析] 273 K,101 kPa即标准状况下,混合气体体积为:
×22.4 L/mol=13.44 L。
[答案] D
8.某非金属单质A和氧气发生化合反应生成B。B为气体,其体积是反应掉氧气体积的两倍(同温同压)。以下对B分子组成的推测一定正确的是 ( )
A.有1个氧原子 B.有2个氧原子
C.有1个A原子 D.有2个A原子
[解析] 由题意,B分子数为氧分子数的2倍,由氧元素守恒,则B分子中定有1个氧原子。
[答案] A
7.下列条件下,两瓶气体所含原子数一定相等的是 ( )
A.同质量、不同密度的N2和CO
B.同温度、同体积的H2和N2
C.同体积、同密度的C2H4和C3H6
D.同压强、同体积的N2O和CO2
[解析] A项N2和CO摩尔质量相同,质量相同时,物质的量相同,分子数相同,所含原子数也相同。B项同温、同体积而压强不同时H2和N2物质的量不同,原子数也不同。C项C2H4和C3H6的碳氢个数比相同,当密度、体积相同时质量相同,原子的总物质的量也相同。D项与B项相似,当温度不同时,原子数不相同。
[答案] AC
6.(2007年广东)下列叙述正确的是 ( )
A.48 g O3气体含有6.02×1023个O3分子
B.常温常压下,4.6 g NO2气体含有1.81×1023个NO2分子
C.0.5 mol·L-1CuCl2溶液中含有3.01×1023个Cu2+
D.标准状况下,33.6 L H2O含有9.03×1023个H2O分子
[解析] B项4.6 g
NO2气体含有NO2的分子数大于3.01×1022个小于6.02×1022个,因为2NO2  N2O4。C项没给CuCl2溶液的体积,Cu2+水解,无法确定。D项标准状况下水是液体。
N2O4。C项没给CuCl2溶液的体积,Cu2+水解,无法确定。D项标准状况下水是液体。
[答案] A
5.(2007年广东理基)已知阿伏加德罗常数为NA,下列说法正确的是 ( )
A.2 mol重水含有NA个D2O分子
B.1 g氢气含有NA个H2分子
C.2 mol钠与过量稀盐酸反应生成NA个H2分子
D.22.4 L水含有NA个H2O分子
[解析] A项2 mol重水应有2 mol D2O分子。B项1 g氢气为0.5 mol氢气,含0.5NA个H2分子。D项不是“标准状况下气体”的计算。
[答案] C
4.(2007年宁夏理综)a g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到a g铜,则参与反应的CuSO4与H2SO4的物质的量之比为 ( )
A.1∶7 B.7∶1
C.7∶8 D.8∶7
[解析] 根据题意,设与CuSO4反应的铁粉为x mol,与H2SO4反应的铁粉为y mol,
Fe+CuSO4===FeSO4+Cu
x x
Fe+H2SO4===FeSO4+H2↑
y
可以得出下列关系式:56(x+y)=64x,
解得x∶y=7∶1。
[答案] B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com