
题目列表(包括答案和解析)
5.(2011广东非公开11)对于0.1mol•L- 1
Na2SO3溶液,正确的是
1
Na2SO3溶液,正确的是
A、升高温度,溶液的pH降低
B、c(Na+)=2c(SO32―)+ c(HSO3―)+ c(H2SO3)
C、c(Na+)+c(H+)=2 c(SO32―)+ 2c(HSO3―)+ c(OH―)
D、加入少量NaOH固体,c(SO32―)与c(Na+)均增大
解析:本题考察盐类水解及外界条件对水解平衡的影响和溶液中离子浓度大小判断。Na2SO3属于强碱弱酸盐,水解显碱性,方程式为SO32-+H2O HSO3-+OH-、HSO3-+H2O
HSO3-+OH-、HSO3-+H2O H2SO3+OH-,因为水解是吸热的,所以升高温度,有利于水解,碱性会增强,A不正确;加入少量NaOH固体,c(OH―)增大,抑制水解,所以c(SO32―)增大,D是正确的;由物料守恒知钠原子个数是硫原子的2倍,因此有c(Na+)=2c(SO32―)+2 c(HSO3―)+ 2c(H2SO3),所以B不正确,有电荷守恒知c(Na+)+c(H+)=2 c(SO32―)+ c(HSO3―)+ c(OH―),因此C也不正确。
H2SO3+OH-,因为水解是吸热的,所以升高温度,有利于水解,碱性会增强,A不正确;加入少量NaOH固体,c(OH―)增大,抑制水解,所以c(SO32―)增大,D是正确的;由物料守恒知钠原子个数是硫原子的2倍,因此有c(Na+)=2c(SO32―)+2 c(HSO3―)+ 2c(H2SO3),所以B不正确,有电荷守恒知c(Na+)+c(H+)=2 c(SO32―)+ c(HSO3―)+ c(OH―),因此C也不正确。
答案:D
4.(2011福建高考10)常温下0.1mol·L-1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是
A.将溶液稀释到原体积的10倍 B.加入适量的醋酸钠固体
C.加入等体积0.2 mol·L-1盐酸 D.提高溶液的温度
解析:醋酸是弱酸,电离方程式是CH3COOH H++CH3COO-,故稀释10倍,pH增加不到一个单位,A项错误;加入适量的醋酸钠固体,抑制醋酸的电离,使其pH增大,可以使其pH由a变成(a+1);B项正确;加入等体积0.2 mol·L-1盐酸,虽然抑制醋酸的电离,但增大了c(H+),溶液的pH减少;C项错误;提高溶液的温度,促进了醋酸的电离,c(H+)增大,溶液的pH减少;D项错误。
H++CH3COO-,故稀释10倍,pH增加不到一个单位,A项错误;加入适量的醋酸钠固体,抑制醋酸的电离,使其pH增大,可以使其pH由a变成(a+1);B项正确;加入等体积0.2 mol·L-1盐酸,虽然抑制醋酸的电离,但增大了c(H+),溶液的pH减少;C项错误;提高溶液的温度,促进了醋酸的电离,c(H+)增大,溶液的pH减少;D项错误。
此题涉及弱电解质的电离平衡移动,切入点都是比较常规的设问,但学生易错选。
答案:B
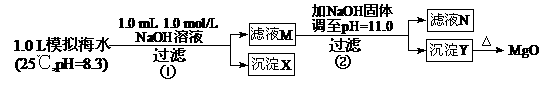
3.(2011浙江高考13)海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
|
模拟海水中的离 子浓度(mol/L) |
Na+ |
Mg2+ |
Ca2+ |
Cl― |
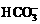 |
|
0.439 |
0.050 |
0.011 |
0.560 |
0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;
实验过程中,假设溶液体积不变。
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;
Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12。
下列说法正确的是
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
解析:步骤①发生Ca2++OH―+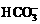
 CaCO3↓+H2O;步骤②:Ksp[Mg(OH)2]=c(Mg2+)×(10-3)2=5.6×10-12,c(Mg2+)=5.6×10-6。Q[Ca(OH)2]=c(Ca2+)×(10-3)2=10-8<Ksp,无Ca(OH)2析出。
CaCO3↓+H2O;步骤②:Ksp[Mg(OH)2]=c(Mg2+)×(10-3)2=5.6×10-12,c(Mg2+)=5.6×10-6。Q[Ca(OH)2]=c(Ca2+)×(10-3)2=10-8<Ksp,无Ca(OH)2析出。
A.正确。生成0001 mol CaCO3。
B.错误。剩余c(Ca2+)=0.001 mol/L。
C.错误。c(Mg2+)=5.6×10-6<10-5,无剩余,
D.错误。生成0.05 mol Mg(OH)2,余0.005 mol OH―,Q[Ca(OH)2]=0.01×0.0052=2.5×10-7<Ksp,无Ca(OH)2析出。
答案:A
[评析]本题考察方式很新颖,主要考察溶度积的计算和分析。解题时要能结合溶度积计算,分析推断沉淀是否产生,要求较高。
答案:BD
2.(2011安徽高考12)室温下,将1.000mol·L-1盐酸滴入20.00mL 1.000mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说 法正确的是
法正确的是
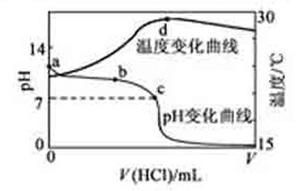
A. a点由水电离出的c(H+)=1.0×10-14mol/L
B. b点:c(NH4+)+c(NH3·H2O)=c(Cl-)
C.c点:c(Cl-)= c(NH4+)
D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
解析:氨水属于弱碱,因此在1.000mol·L-1氨水中OH-的浓度不会是1.000mol·L-1而是要小于1.000mol·L-1,由水得离子积常数可知溶液中H+浓度应大于1.0×10-14mol/L,A不正确;由图像可知b点溶液显碱性,说明此时氨水有剩余,即溶液是由氨水和氯化铵组成的,因此有c(NH4+)+c(NH3·H2O)>c(Cl-),B不正确;由图像可知c点溶液显中性,由电荷守衡可知c(H+)+c(NH4+)=c(OH-)+c(Cl-),所以c(NH4+)=c(Cl-),C正确;由图像可知d点后溶液中主要物质是NH4Cl,而NH4Cl要水解吸热,所以温度会略有降低,D也不正确。
答案:C
1.(2011江苏高考14)下列有关电解质溶液中微粒的物质的量浓度关系正确的是
A.在0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
B.在0.1 mol·L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3-)
C.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液:
c(CO32-)> c(HCO3-)> c(OH-)>c(H+)
D.常温下,CH3COONa和CH3COOH混合溶液[pH=7, c(Na+)=0.1 mol·L-1]:
c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-)
继续:本题属于基本概念与理论的考查,落点在水解与电离平衡、物料守恒和电荷守恒、离子浓度大小比较。溶液中存在水解与电离两个过程的离子浓度大小比较似乎是考试热点内容,高三复习中要反复加强训练。
A.在0.1 mol·L-1NaHCO3溶液中,HCO3-在溶液中存在水解与电离两个过程,而溶液呈碱性,说明水解过程大于电离过程,c(H2CO3)>c(CO32-)
B.c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3-)中把c(H+)移项到等式另一边,即是质子守恒关系式。
C.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液后,相当于0.05 mol·L-1的Na2CO3溶液和NaHCO3溶液的混合液,由于Na2CO3的水解程度大于NaHCO3的水解程度,因此正确的关系是:c(HCO3-)>c(CO32-)> c(OH-)>c(H+)。
D.常温下,CH3COONa和CH3COOH混合溶液,包括CH3COO-水解和CH3COOH电离两个过程,既然pH=7, 根据电荷守恒式,不难得出c(Na+)=c(CH3COO-) =0.1 mol· L-1,c(H+)=c(OH-)=1×10-7 mol·L-1。水解是有限的,c(CH3COOH)>c(CH3COO-)。
18.(09广东化学 24)(11分)
24)(11分)
 超细氧化铝是一种重要的功能陶瓷原料。
超细氧化铝是一种重要的功能陶瓷原料。

 (1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式
。
(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式
。
 (2)NH4Al(SO4)2·12H2O的相对分子质量为453。欲配制100mLPH为2、浓度约为0.1mol-1的NH4Al(SO4)2溶液,配制过程为
(2)NH4Al(SO4)2·12H2O的相对分子质量为453。欲配制100mLPH为2、浓度约为0.1mol-1的NH4Al(SO4)2溶液,配制过程为
 ①用托盘天平称量NH4Al(SO4)2·12H2O固体
g;
①用托盘天平称量NH4Al(SO4)2·12H2O固体
g;
 ②将上述固体置于烧杯中
。
②将上述固体置于烧杯中
。
 (3)在0.1mol·L-1NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液PH变化的关系见下图
(3)在0.1mol·L-1NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液PH变化的关系见下图


 ①用NaOH溶液调节(2)中溶液PH至7,该过程中发生反应的离子方程式有
。
①用NaOH溶液调节(2)中溶液PH至7,该过程中发生反应的离子方程式有
。
 ②请在答题卡的框图中,画出0.01mol·L-1NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液PH变化的关系图,并进行必要的标注。
②请在答题卡的框图中,画出0.01mol·L-1NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液PH变化的关系图,并进行必要的标注。
 答案:
答案:
(1)2NH4AlO(OH)HCO3 Al2O3+3H2O+2CO2↑+2NH3↑
Al2O3+3H2O+2CO2↑+2NH3↑
 (2)①4.5g;②再向烧杯中加入100mL蒸馏水,充分搅拌至固体溶解
(2)①4.5g;②再向烧杯中加入100mL蒸馏水,充分搅拌至固体溶解
 (3)① H++OH-=H2O NH4++ OH-=
NH3·H2O Al3++3OH-=Al(OH)3↓;
(3)① H++OH-=H2O NH4++ OH-=
NH3·H2O Al3++3OH-=Al(OH)3↓;

 ②
②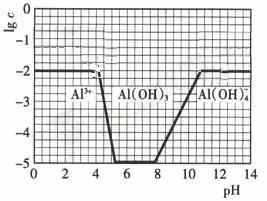
 解析:
解析:
(1)根据NH4AlO(OH)HCO3组成联系到碳酸氢铵盐的分解可知:2NH4AlO(OH)HCO3 Al2O3+3H2O+2CO2↑+2NH3↑;
Al2O3+3H2O+2CO2↑+2NH3↑;
 (2)由物质的量浓度的定义公式可计算:
(2)由物质的量浓度的定义公式可计算:
 m(NH4Al(SO4)2·12H2O)=n·M(NH4Al(SO4)2·12H2O)=c·V·M(NH4Al(SO4)2·12H2O)
m(NH4Al(SO4)2·12H2O)=n·M(NH4Al(SO4)2·12H2O)=c·V·M(NH4Al(SO4)2·12H2O)
 =0.1mol/L×100mL×10-3×453g/mol=4.53g,由于托盘天平的精确度为0.1g,故为4.5g;
=0.1mol/L×100mL×10-3×453g/mol=4.53g,由于托盘天平的精确度为0.1g,故为4.5g;
 (3)①由图像可知,开始阶段c(Al3+)没变化;而后c(Al3+)降低,生成Al(OH)3沉淀;当pH>8,Al(OH)3沉淀开始溶解。调节pH至7,OH-先跟NH4+反应,然后与Al3+反应生成Al(OH)3沉淀。
(3)①由图像可知,开始阶段c(Al3+)没变化;而后c(Al3+)降低,生成Al(OH)3沉淀;当pH>8,Al(OH)3沉淀开始溶解。调节pH至7,OH-先跟NH4+反应,然后与Al3+反应生成Al(OH)3沉淀。
17.(09广东化学 22)(12分)
22)(12分)
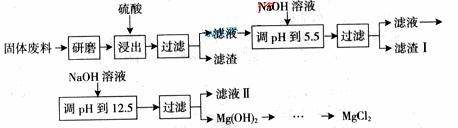
 某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:

|
沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
PH |
3.2 |
5.2 |
12.4 |
 部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题:
部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题:
 (1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有
(要求写出两条)。
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有
(要求写出两条)。
 (2)滤渣I的主要成分有 。
(2)滤渣I的主要成分有 。
 (3)从滤渣Ⅱ中可回收利用的主要物质有 。
(3)从滤渣Ⅱ中可回收利用的主要物质有 。
 (4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备
(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备 :
:
 MgCl2+2NaClO3===Mg(ClO3)2+2NaCl
MgCl2+2NaClO3===Mg(ClO3)2+2NaCl
 已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:

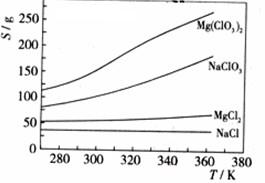
 ①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因:
。
①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因:
。
 ②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是:
。除去产品中该杂质的方法是:
。
②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是:
。除去产品中该杂质的方法是:
。
 答案:
答案:
(1)升高温度、搅拌、过滤后再向滤渣中加入硫酸(多次浸取)
 (2)Fe(OH)3 Al(OH)3
(2)Fe(OH)3 Al(OH)3
 (3)Na2SO4
(3)Na2SO4
 (4)①在某一时NaCl最先达到饱和析出;Mg(ClO3)2的溶解度随温度变化最大;NaCl 的溶解度与其他物质的溶解度有一定的差别。
(4)①在某一时NaCl最先达到饱和析出;Mg(ClO3)2的溶解度随温度变化最大;NaCl 的溶解度与其他物质的溶解度有一定的差别。
 ②降温前溶液中NaCl以达饱和;降低过程中NaCl溶解度会降低 ,会少量析出。重结晶。
②降温前溶液中NaCl以达饱和;降低过程中NaCl溶解度会降低 ,会少量析出。重结晶。
 解析:
解析:
浸出步骤硫酸同固体废料中主要成份反应,从化学反应速率和化学平衡的影响因素来看,可通过升高温度提高硫酸镁的溶解度,或通过搅拌使反应物充分接触反应,或通过过滤后滤渣多次浸取以提高转化率。硫酸浸出液经过滤,滤液中主要溶质是MgSO4、Al2(SO4)3和Fe2(SO4)3,根据阳离子以氢氧化物形式完全沉淀时溶液的pH,在调节pH至5.5时,Fe3+和Al3+已经完全沉淀,滤渣I的主要成分是Fe(OH)3 Al(OH)3,此时滤液中阴离子主要是SO42-,加入NaOH后Mg2+完全沉淀,溶质主要成分是Na2SO4;反应MgCl2+2NaClO3===Mg(ClO3)2+2NaCl类似于侯德榜制碱法生成NaHCO3的原理,因为NaCl溶解度小而从溶液中析出,使反应向生成Mg(ClO3)2的方向进行;同样是依据①的原理,在降温的过程中,Mg(ClO3)2的溶解度不断减小,从溶液中析出,在生成Mg(ClO3)2的过程中NaCl也不断生成,但因溶解度没有增加,所以也伴随Mg(ClO3)2析出;相同温度时氯化钠的溶解度最小,因此在冷却降温析出Mg(ClO3)2过程中一定会析出氯化钠。由于氯酸镁和氯化钠均溶于水,溶于水的可溶性物质一般用结晶和重结晶的方法分离。
16.(09福建卷 24)(13分)
24)(13分)
 从铝土矿(主要成分是
从铝土矿(主要成分是 ,含
,含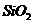 、
、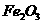 、MgO等杂质)中提取两种工艺品的流程如下:
、MgO等杂质)中提取两种工艺品的流程如下:

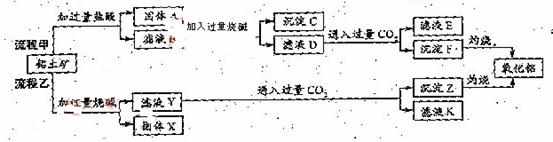
 请回答下列问题:
请回答下列问题:
 (1)流程甲加入盐酸后生成Al3+的方程式为_________.
(1)流程甲加入盐酸后生成Al3+的方程式为_________.
 (2)流程乙加入烧碱后生成Si
(2)流程乙加入烧碱后生成Si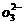 的离子方程式为________.
的离子方程式为________.
 (3)验证滤液B含
(3)验证滤液B含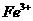 ,可取少量滤液并加入________(填试剂名称)。
,可取少量滤液并加入________(填试剂名称)。
 (4)滤液E、K中溶质的主要成份是________(填化学式),写出该溶液的一种用途________
(4)滤液E、K中溶质的主要成份是________(填化学式),写出该溶液的一种用途________
 (5)已知298K时,
(5)已知298K时,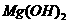 的容度积常数
的容度积常数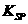 =5.6×
=5.6× ,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得PH=13.00,则此温度下残留在溶液中的
,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得PH=13.00,则此温度下残留在溶液中的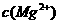 =_______.
=_______.
答案:
(1)Al2O3
+ 6H+  2Al3+ +3H2O
2Al3+ +3H2O
(2)SiO2 + 2OH-  SiO32 - + H2O
SiO32 - + H2O
(3)硫氰化钾(或硫氰酸钾、苯酚溶液等合理答案:)
(4)NaHCO3;制纯碱或做发酵粉等合理答案:
(5)5.6×10-10mol/L
 解析:
解析:
本题考查铝土矿中氧化铝提取的工艺流程。(1)与HCl反应生成Al3+,应为铝土矿中Al2O3。(2)SiO2可以溶于NaOH中生成Na2SiO3。(3)检验Fe3+的特征反应很多,如与KSCN显血红色,与苯酚显紫色,与OH-显红褐色沉淀等。(4)生成E、K时,CO2均是过量的,故应生成NaHCO3。(5)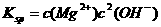 ,
,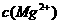 =5.6×10-12/(0.1)2=5.6×10-10。
=5.6×10-12/(0.1)2=5.6×10-10。
15.(09安徽卷27) (12分)
(12分)
 某厂废水中含5.00×10-3mol·L-1的
某厂废水中含5.00×10-3mol·L-1的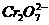 ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料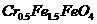 (
(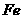 的化合价依次为+3、+2),设计了如下实验流程:
的化合价依次为+3、+2),设计了如下实验流程:
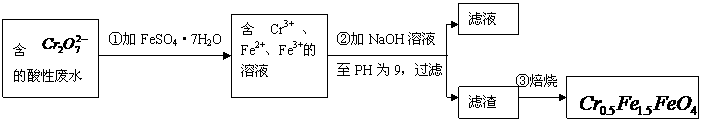






 (1)第①步反应的离子方程式是
(1)第①步反应的离子方程式是
 (2)第②步中用PH试纸测定溶液PH的操作是:
(2)第②步中用PH试纸测定溶液PH的操作是:

 (3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有
 (4)欲使1L该废水中的
(4)欲使1L该废水中的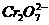 完全转化为
完全转化为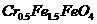 。理论上需要加入
。理论上需要加入
 GFeSO4·7H2O。
GFeSO4·7H2O。
 答案:
答案:
 (1)Cr2O72- + 6Fe2+ + 14H+
(1)Cr2O72- + 6Fe2+ + 14H+  2Cr3+ + 6Fe3+ + 7H2O
2Cr3+ + 6Fe3+ + 7H2O
 (2)将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照。
(2)将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照。

 (3)Fe(OH)3、Fe(OH)2
(3)Fe(OH)3、Fe(OH)2
 (4)13.9
(4)13.9
 解析
解析
 (1)第①步是Cr2O72-与Fe2+发生氧化还原反应,方程式为:Cr2O72-+6Fe2++
(1)第①步是Cr2O72-与Fe2+发生氧化还原反应,方程式为:Cr2O72-+6Fe2++ 14H+=2Cr3++6Fe3++7H2O;
14H+=2Cr3++6Fe3++7H2O;
(2)测定溶液的pH的方法是:用玻璃棒蘸取待测溶液滴在pH试纸的中心位置,然后对照标准比色卡,读出对应颜色的数据;
(3)从最终所得磁性材料的化学式可知,滤渣中主要有Cr(OH)3、Fe(OH)2、Fe(OH)3;
(4)1L废水中的n(Cr2O72-)=5.00×10-3mol,根据关系式:Cr2O72--4Cr0.5Fe1.5FeO4-10FeSO4·7H2O,所以理论上n(FeSO4·7H2O)=0.05mol,m(FeSO4·7H2O)= 0.05mol×278g·mol-1=13.9g。
14.(09全国卷Ⅱ 29)
(15分)
29)
(15分)

 现有A、B、C、D、E、F六种化合物,已知它们的阳离子有
现有A、B、C、D、E、F六种化合物,已知它们的阳离子有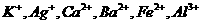 ,
, 阴离子有
阴离子有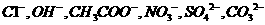 ,现将它们分别配成
,现将它们分别配成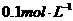 的溶液,进行如下实验:
的溶液,进行如下实验:
①

 测得溶液A、C、E呈碱性,且碱性为A>E>C;
测得溶液A、C、E呈碱性,且碱性为A>E>C;
②

 向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨
向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨 水,沉淀消失;
水,沉淀消失;
③

 向D溶液中滴加
向D溶液中滴加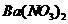 溶液,无明显现象;
溶液,无明显现象;
④

 向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。

 根据上述实验现象,回答下列问题:
根据上述实验现象,回答下列问题:
(1)

 实验②中反应的化学方程式是
实验②中反应的化学方程式是

 ;
;

 (2)E溶液是 ,判断依据是
(2)E溶液是 ,判断依据是

 ;
;

 (3)写出下列四种化合物的化学式:A
、C
、
(3)写出下列四种化合物的化学式:A
、C
、

 D
、F
.
D
、F
.

 答案:
答案:
(1)
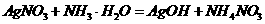


(2) 碳酸钾 由①中碱性减弱的顺序可知,E是碳酸盐。六种阳离子中可以与碳酸根形成可溶性盐的只有钾离子,所以E是碳酸钾
碳酸钾 由①中碱性减弱的顺序可知,E是碳酸盐。六种阳离子中可以与碳酸根形成可溶性盐的只有钾离子,所以E是碳酸钾
(3)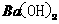

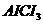
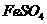


 解析:
解析:
本题考查离子共存、盐类水解综合运用。根据溶液的性质,确定CO32-只能与K+形成显碱性的溶液,另外可能形成的碱性溶液为碱Ba(OH)2 。由于醋酸的酸性大于碳酸,所以醋酸盐水解的碱性小于碳酸盐,因此A为Ba(OH)2,E为K2CO3,C为醋酸盐,由②可得B中阳离子为Ag+,则肯定为AgNO3,由③可得D中无SO42-,则F中的阴离子为SO42-,D中的阴离子为Cl-。由④可得F中的阳离子为Fe2+,即F为FeSO4,而CH3COO-若与Al3+形成溶液时,Al3+也发生水解,所以C为醋酸钙,而D为AlCl3。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com