
题目列表(包括答案和解析)
 2NH3(g)△H=-92.2kJ/mol
2NH3(g)△H=-92.2kJ/mol 2NH3(g)△H=-92.2kJ/mol
2NH3(g)△H=-92.2kJ/mol
| ||
| ||


| ||
| ||
 2SO3(g);△H=-196.6KJ?mol-1.平衡时容器内气体压强为起使时的90%.
2SO3(g);△H=-196.6KJ?mol-1.平衡时容器内气体压强为起使时的90%.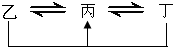 元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题:
元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题:

一.选择题(48分)
题号
1
2
3
4
5
6
7
8
答案
A
D
A
C
B
C
B
B
题号
9
10
11
12
13
14
15
16
答案
A
D
C
C
B
B
D
A
二.非选择题(52分)
17.(1) .
. (2)
(2) .
. (3)
(3)
(4) (每空2分,答错或少答1个扣1分,扣到0分为止)
(每空2分,答错或少答1个扣1分,扣到0分为止)
18.(1)验证锂.钠.钾的活泼性(或同一主族,从上到下元素的金属性逐渐增强)(2分);c(1分)
(2)① (各1分)
(各1分)
② (或
(或 (2分)
(2分)
19.(1)第三周期 ⅦA(1分)
(2) 氯碱(2分)
氯碱(2分)

(3)
(4) ;
; KJ/mol(2分)
KJ/mol(2分)
或 ;
; KJ/mol
KJ/mol
(5)离子晶体(1分)
20.(1)硫  离子键.非极性键(4分)
离子键.非极性键(4分)
(2) (2分)
(2分)
(3)① (2分)
(2分)
② (2分)
(2分)
21.(1)
(2)分液漏斗(1分)
(3)饱和食盐水(或饱和氯水)(1分)浓硫酸(1分)
(4) (1分)酒精(汽油.苯等有机溶剂或其他合理答案)(1分)
(1分)酒精(汽油.苯等有机溶剂或其他合理答案)(1分)
(5)使生成的 升华,与其他固体分离(2分)
升华,与其他固体分离(2分)
(6)吸收多余的 ,防止污染空气(1分)
,防止污染空气(1分)
(7)连接 的导管易被
的导管易被 固体堵塞(2分)
固体堵塞(2分)
22.(1)0.16 (2)0.03 0.05 (3)5.72
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com