
题目列表(包括答案和解析)
已知0.5 mol甲烷与0.5 mol水蒸气在t ℃.p kPa时,完全反应生成一氧化碳和氢气,吸收了a kJ热量,该反应的热化学方程式是: 。
已知下列热化学方程式:
①CaCO3(s)===CaO(s)+CO2(g) ΔH=177.7 kJ
②C(s)+H2O(s)===CO(g)+H2(g) ΔH=-131.3 kJ/mol
③![]() H2SO4(l)+NaOH(l)===
H2SO4(l)+NaOH(l)===![]() Na2SO4(l)+H2O(l) ΔH=-57.3 kJ/mol
Na2SO4(l)+H2O(l) ΔH=-57.3 kJ/mol
④C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
⑤CO(g)+![]() O2(g)===CO2(g) ΔH=-283 kJ/mol
O2(g)===CO2(g) ΔH=-283 kJ/mol
⑥HNO3(aq)+NaOH(aq)===NaNO3(aq)+H2O(l) ΔH=-57.3 kJ/mol
⑦2H2(g)+O2(g)===2H2O(l) ΔH=-517.6 kJ/mol
(1)上述热化学方程式中,不正确的有___________,不正确的理由分别___________。
(2)根据上述信息,写出C转化为CO的热化学方程式:____________________。
(3)上述反应中,表示燃烧热的热化学方程式有_________;表示中和热的热
化学方程式有______________。(填序号)
(4)已知0.5 mol甲烷与0.5 mol水蒸气在t ℃.p kPa时,完全反应生成一氧化碳和氢气,
吸收了a kJ热量,该反应的热化学方程式是: 。
(一) (1)甲烷也是一种清洁燃料,但不完全燃烧时热效率降低并会产生有毒气体造成污染。
已知: CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH1=―890.3 kJ/mol
2CO (g) + O2(g) = 2CO2(g) ΔH2=―566.0 kJ/mol
则甲烷不完全燃烧生成一氧化碳和液态水时的热效率只是完全燃烧时的________倍(计算结果保留1位小数)。
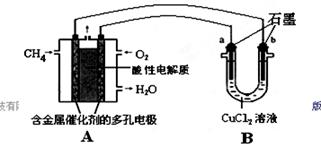
(2)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol/L的氯化铜溶液的装置示意图:
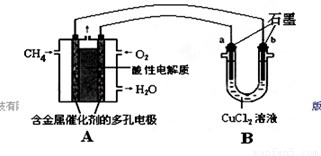
请回答:
①甲烷燃料电池的负极反应式是________。
②当线路中有0.1 mol电子通过时,________(填“a”或“b”)极增重________g。
(二)下表是几种弱电解质的电离平衡常数、难溶电解质的
溶度积Ksp (25℃)。
|
电解质 |
平衡方程式 |
平衡常数K |
Ksp |
|
CH3COOH |
CH3COOH |
1.76×10-5 |
|
|
H2CO3 |
H2CO3 HCO3- |
K1=4.31×10-7 K2=5.61×10-11 |
|
|
C6H5OH |
C6H5OH |
1.1×10-10 |
|
|
H3PO4 |
H3PO4 H2PO4- HPO42- |
K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
|
|
NH3·H2O |
NH3·H2O |
1.76×10-5 |
|
|
BaSO4 |
BaSO4 |
|
1.07×10-10 |
|
BaCO3 |
BaCO3 |
|
2.58×10-9 |
回答下列问题:
(1)由上表分析,若①CH3COOH ②HCO3- ③C6H5OH ④H2PO4- 均可看作酸,则它们酸性由强到弱的顺序为__________________________(填编号);
(2)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)______c(NH4+);(填“>”、“=”或“<”)
(3)25℃时,向10ml 0.01mol/L苯酚溶液中滴加Vml 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是( );
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c((NH4+) >c (C6H5O-) >c (H+)>c (OH-)
C.V=10时,混合液中水的电离程度小于10ml 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+ 2 c (NH4+)= c (C6H5O-)+ c (C6H5OH)
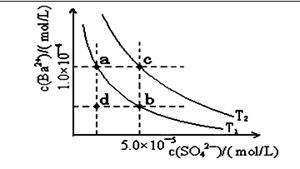
(4)如下图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法不正确的是( )
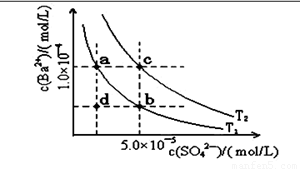
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时, 均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、 b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
(一)(1)甲烷也是一种清洁燃料,但不完全燃烧时热效率降低并会产生有毒气体造成污染。
已知: CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH1=―890.3 kJ/mol
2CO (g) + O2(g) = 2CO2(g) ΔH2=―566.0 kJ/mol
则甲烷不完全燃烧生成一氧化碳和液态水时的热效率只是完全燃烧时的________倍(计算结果保留1位小数)。
(2)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol/L的氯化铜溶液的装置示意图: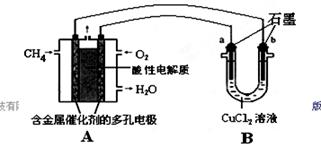
请回答:
①甲烷燃料电池的负极反应式是________。
②当线路中有0.1 mol电子通过时,________(填“a”或“b”)极增重________g。
(二)下表是几种弱电解质的电离平衡常数、难溶电解质的
溶度积Ksp (25℃)。
| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH CH3COO-+H+ CH3COO-+H+ | 1.76×10-5 | |
| H2CO3 | H2CO3 H++HCO3- H++HCO3-HCO3-  H++CO32- H++CO32- | K1=4.31×10-7 K2=5.61×10-11 | |
| C6H5OH | C6H5OH  C6H5O-+H+ C6H5O-+H+ | 1.1×10-10 | |
| H3PO4 | H3PO4 H++H2PO4- H++H2PO4-H2PO4-  H++HPO32- H++HPO32-HPO42-  H++PO43- H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
| NH3·H2O | NH3·H2O NH4++OH- NH4++OH- | 1.76×10-5 | |
| BaSO4 | BaSO4 Ba2++SO42- Ba2++SO42- | | 1.07×10-10 |
| BaCO3 | BaCO3 Ba2++CO32- Ba2++CO32- | | 2.58×10-9 |
| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH CH3COO-+H+ CH3COO-+H+ | 1.76×10-5 | |
| H2CO3 | H2CO3 H++HCO3- H++HCO3-HCO3-  H++CO32- H++CO32- | K1=4.31×10-7 K2=5.61×10-11 | |
| C6H5OH | C6H5OH  C6H5O-+H+ C6H5O-+H+ | 1.1×10-10 | |
| H3PO4 | H3PO4 H++H2PO4- H++H2PO4-H2PO4-  H++HPO32- H++HPO32-HPO42-  H++PO43- H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
| NH3·H2O | NH3·H2O NH4++OH- NH4++OH- | 1.76×10-5 | |
| BaSO4 | BaSO4 Ba2++SO42- Ba2++SO42- | | 1.07×10-10 |
| BaCO3 | BaCO3 Ba2++CO32- Ba2++CO32- | | 2.58×10-9 |
题号
1
2
3
4
5
6
7
8
答案
D
C
D
B
D
A
B
C
题号
9
10
11
12
13
14
答案
BD
BC
AD
B
A
D
15.(11分)
(1)1S2 2S2 2P6 3S2 3P5(1分)
(2)6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑(2分)
(3)(共3分)促进氯气从反应混合物中逸出(1分);
稀盐酸(1分);
盐酸还原已生成的碘酸氢钾(1分)。
(4)KOH;KH(IO3)2+KOH=2KIO3+H2O(各1分,共2分)
(5)反应产生的氯气跟KOH反应生成KClO(1分),
KClO能将KIO3氧化成KIO4(1分)从而不能得到碘酸钾(1分)。(共3分)
16.(11分) ( l ) 控制气流速度 让气体混合均匀 干操混合气体.(各1 分)
 (2 ) 吸收过量的氯气(1 分) (3)分液(1 分)
(2 ) 吸收过量的氯气(1 分) (3)分液(1 分)
(4)CH4 + 2Cl
(5)A B(各得1分,选错为0) (6)2.05mol/L(2分)
17.(6分)⑴ NH2OH + 2O2― + H+= NO2― + H2O2 + H2O(2分)
⑵ 5.000×10―3 mol?L―1(2分)
⑶ 2MnO4―+5H2O2+6H+=2Mn2++5O2↑+8H2O(2分)
(或Cr2O72―+3H2O2 + 8H+ =2Cr3+ +3O2↑+7H2O)
18.(10分)(1)NH3 NaAlO2
(2)
(3) CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32-(HCO3-也可)
CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32-(HCO3-也可)
(4)Al4SiC4+2N2 4AlN+SiC+
4AlN+SiC+
(每空2分,条件不写扣1 分)
19、(10分)(1)CH4(g)+H2O(g) CO(g)+3H2(g);△H=+
CO(g)+3H2(g);△H=+
(2分,条件不写扣1分)
(2)增大氮气和氢气的浓度有利于增大反应速率;减小氨气的浓度,增大氮气和氢气的浓度都有利于平衡向正反应方向移动。(各1分)
(3)1.12×108(2分)
(4) (各2分)
(各2分)
20、(16分)(Ⅰ)(1) (2分)(2)③,⑤ (各1分)
(2分)(2)③,⑤ (各1分)
|