
题目列表(包括答案和解析)
铜是一种与人类关系非常密切的有色金属。常温下,Cu2+在溶液中稳定, Cu+在酸性条件下易发生歧化反应:2Cu+=Cu2++Cu;大多数 +1价铜的化合物是难溶 物,如:Cu20、Cul、CuCl、CuH 等。
(1)在CuCl2溶液中逐滴加入过量KI溶液,可能发生的反应有:
2Cu2++4I-=2CuI↓(白色)+I2; 2Cu2++4I-+2Cl-=CuCl↓(白色)+I2
已知:常温下Ksp(CuCl)=1.20×10-6(mol/L)2; Ksp(CuI)=5.06×10-12(mol/L)2。 由此推断上述反应生成主要沉淀物的化学式是______。
(2)向CuH中加入过量稀HC1,有气体生成,该反应的离子方程式为______。
(3)将 冰 铜(由Cu2S和FeS熔合成含Cu 18%—20%的一种物质)加入熔剂,在髙温下 吹入空气,冰铜中的Cu2S被氧化为Cu2O,生 成 的Cu2O与Cu2S反应生成粗铜。上述两个反应的化学方程式分别是______、______。
(4)常温下,向0.20 mol • L-1硫酸铜溶液中加入氢氧化钠溶液,生成浅蓝色氢氧化铜 沉淀,当溶液的pH = 6时,c(Cu2+)=______mol.L‑1。[已知:Ksp(CuI)=2.2×10-20(mol/L)3]
(5)将0.80 gCuSO4 • 5H2O样品加热分解,其脱水过程中固体质量随温度的变化如下图所示。
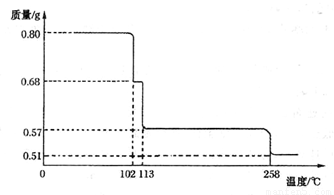
请 确定110°C时固体物质的化学式____________。(要求写出推断过程)
铜是一种与人类关系非常密切的有色金属。常温下,Cu2+在溶液中稳定,Cu+在酸性条件下易发生歧化反应:2Cu+=Cu2++Cu;大多数+1价铜的化合物是难溶物,如:Cu20、Cul、CuCl、CuH 等。
(1)在CuCl2溶液中逐滴加入过量KI溶液,可能发生的反应有:
2Cu2++4I-=2CuI↓(白色)+I2; 2Cu2++4I-+2Cl-=CuCl↓(白色)+I2
已知:常温下Ksp(CuCl)=1.20×10-6(mol/L)2; Ksp(CuI)=5.06×10-12(mol/L)2。由此推断上述反应生成主要沉淀物的化学式是______。
(2)向CuH中加入过量稀HC1,有气体生成,该反应的离子方程式为______。
(3)将冰铜(由Cu2S和FeS熔合成含Cu 18%—20%的一种物质)加入熔剂,在髙温下吹入空气,冰铜中的Cu2S被氧化为Cu2O,生成的Cu2O与Cu2S反应生成粗铜。上述两个反应的化学方程式分别是______、______。
(4)常温下,向0.20 mol ? L-1硫酸铜溶液中加入氢氧化钠溶液,生成浅蓝色氢氧化铜沉淀,当溶液的pH = 6时,c(Cu2+)=______mol.L?1。[已知:Ksp(CuI)=2.2×10-20(mol/L)3]
(5)将0.80 gCuSO4 ? 5H2O样品加热分解,其脱水过程中固体质量随温度的变化如下图所示。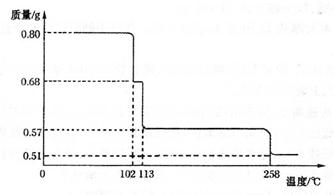
请确定110°C时固体物质的化学式____________。(要求写出推断过程)
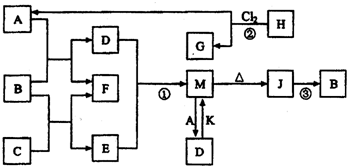
下图每一方框中的字母代表一种反应物或生成物。

(1)若X由M、N两种短周期且同周期元素形成 ,M原子的最外层电子数是最内层电子数的![]() N元素最高正价与它的负价代数和为6。
N元素最高正价与它的负价代数和为6。
①写出反应Ⅱ的离子方程式 。
②下图为IV达到平衡后改变反应条件,反应速率随时间变化的情况,已知t2-t3阶段为便用催化剂;t3-t4阶段为减小体系的压强,写出符合上述条件的化学方程式 (写一个即可,用具体物质表示);若t4-t5阶段为升高体系的温度,则该反应为 (填“放热”或“吸热”)
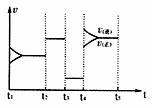
③某温度下,四个容器中均进行着上述反应,各物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
| 容器编号 | C(C)/mol?L―1 | C(D)/mol?L―1 | C(G)/mol?L―1 | V正、V逆比较 |
| 甲 | 0.06 | 0.60 | 0.60 | V正=V逆 |
| 乙 | 0.6 | 0.50 | 0.40 | |
| 丙 | 0.12 | 0.40 | 0.80 | V正<V逆 |
| 丁 | 0.12 | 0.30 | V正=V逆 |
(2)若X是一种含氧酸盐,B是金属单质,C、D是非金属单质,反应Ⅱ需要B与A的浓溶液共热才能进行,且生成的E与G是同一种物质。写出反应Ⅰ的化学方程式 ;4g固态D在C中完全反应放出37.2kJ的热量,写出该反应的热化学方程式 。
甲、乙、丙、丁四种单质在点燃条件下两两化合生成X、Y、Z、W四种化合物,转化关系如右图所示。
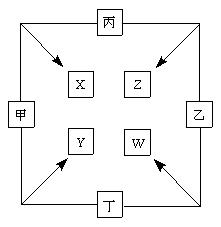
已知:
甲、乙、丙均为前三周期元素的单质,常温下均为气体,丁是日常生活中的一种常见金属。
常温下,X是无色液体,Y是黑色固体。
丙在乙中燃烧发出苍白色的![]() 火焰,W的水溶液呈黄色。
火焰,W的水溶液呈黄色。
请回答:
(1)写化学式:甲_____________, Z_____________。
(2)丁与X在高温下也能得到Y,请写出该反应的化学方程式
___________________________________________________。
(3)将少量W的溶液滴入几滴KSCN溶液,迅速变为红色,请写出该反应的化学方程式____________________________________________________。
(4)甲与丙两单质的元素可形成原子个数比1∶1的化合物H,将H滴入品红后,溶液的颜色逐渐褪去,加热后溶液为 (填颜色)。
(5)将Y恰好溶于Z的水溶液后,检验其中低价金属离子的方法是滴入酸性KMnO4,紫色褪去,说明有该离子,仔细分析后发现该结论存在缺陷,此“缺陷”是 。
 (1)C中存在的化学键类型为
(1)C中存在的化学键类型为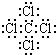

| ||
| 冰晶石 |
| ||
| 冰晶石 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com