
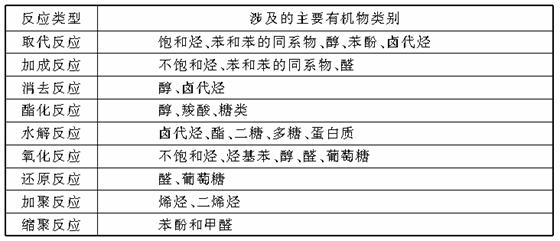
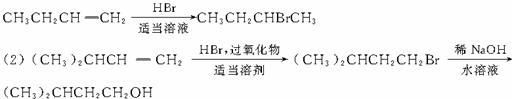
3.有机化学反应类型
重要有机反应类型和涉及的主要有机物类别
2.烃的衍生物的分类及相互转化关系
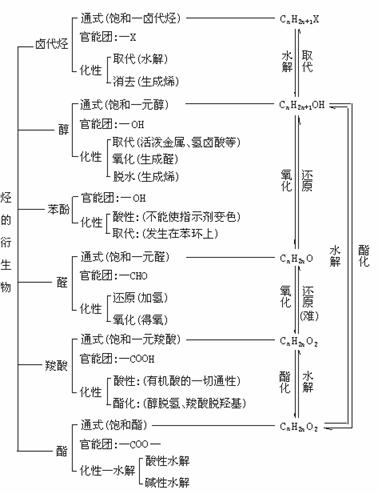
(1)烃的衍生物的化学性质取决于官能团。但官能团相同,其有机物的化学性质不一定完全相同。如苯酚和乙醇官能团同为羟基,化学性质却不完全相同:苯酚显酸性,能与溴水发生取代反应,与Fe3+发生显色反应;而乙醇没有酸性,只与氢卤酸发生取代反应,还能发生消去反应、酯化反应等。
(2)含有多个官能团,具有多个官能团的性质,但官能团之间相互有影响:如甲酸
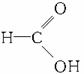
有醛基、羧基,因此能发生氧化反应、中和反应。
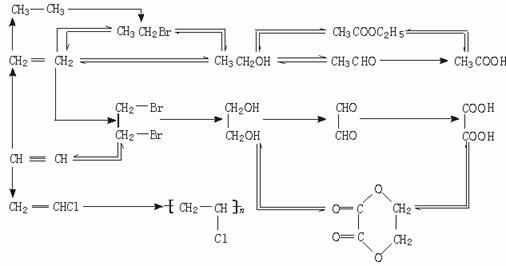
(3)有机物间的相互衍变关系
1.有机物重要物理性质的规律
(1)有关密度的规律。物质的密度是指单位体积里所含物质的质量,它与该物质的相对分子质量、分子半径等因素有关。一般讲,有机物的密度与分子中相对原子质量大的原子所占质量分数成正比。例如,烷、烯、炔及苯和苯的同系物等物质的密度均小于水的密度(即ρ烃<1),并且它们的密度均随着分子中碳原子数的增加和碳元素的质量分数的增大而增大;而一卤代烷、饱和一元醇随分子中碳原子数的增加,氯元素、氧元素的质量分数降低,密度逐渐减小。
(2)水溶性规律。有机物是否溶于水与组成该有机物的原子团(包括官能团)有密切关系。在有机物分子常见的官能团中,-OH、-CHO、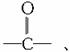 -COOH、-SO3H等,皆为亲水基,-R、-NO2、-X、
-COOH、-SO3H等,皆为亲水基,-R、-NO2、-X、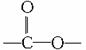 等皆为憎水基。一般来讲,有机物分子中当亲水基占主导地位时,该有机物溶于水;当憎水基占主导地位时,则难溶于水。由此可推知:
等皆为憎水基。一般来讲,有机物分子中当亲水基占主导地位时,该有机物溶于水;当憎水基占主导地位时,则难溶于水。由此可推知:
①烃类均难溶于水,因其分子内不含极性基团。
②含有-OH、-CHO、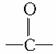 及-COOH的各类有机物(如醇、醛、酮、羧酸),其烃基部分碳原子数小于等于3时可溶于水。
及-COOH的各类有机物(如醇、醛、酮、羧酸),其烃基部分碳原子数小于等于3时可溶于水。
③当活泼金属原子取代有机物分子中的氢原子后所得的产物可溶于水。如CH3CH2ONa、CH3COONa、C6H5ONa等。
(3)熔、沸点规律。熔、沸点是物质状态变化的标志,有机物溶、沸点的高低与分子间相互作用、分子的几何形状等因素有关。
①结构相似的有机物,相对分子质量越大,分子间力越大,其熔、沸点越高。如链烃同系物的沸点,随着相对分子质量的增大而升高,状态由气态(分子中碳原子数小于等于4者及新戊烷通常为气态)到液态,最后变为固态。
②在同分异构体中,一般支链越多,分子间接触越困难,分子间力越小,其熔、沸点越低。如沸点:正戊烷>异戊烷>新戊烷。但熔点有例外,如新戊烷>正戊烷>异戊烷。
③分子的极性越强,分子间引力越大,故相对分子质量相近的有机物,其分子的极性越强,沸点就越高。如沸点:CH3CH2OH>CH3CH2Cl>CH3CH3。
67.答案:①CH2==CH2+H2O CH3CH2OH
CH3CH2OH
②2CH3CH2OH+O2 2CH3CHO+2H2O
2CH3CHO+2H2O
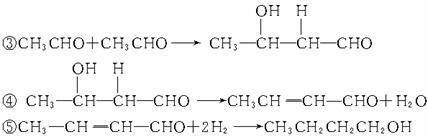
解析:由信息可知,由醛的互相反应可增长碳链,所以由乙烯制正丁醇应首先制得乙醛,然后进入信息,后续反应也即可完成。
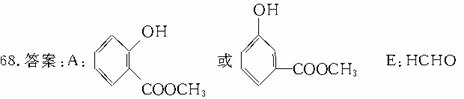
反应类型:(Ⅰ)水解,(Ⅱ)酯化,(Ⅲ)取代
反应方程式:
解析:解此题的关键是确定A。给出的条件有:①分子式C8H8O3;②无色液体、难溶于水;③有香味,推为酯;④与NaOH水溶液加热生成B+C(进一步证明为酯):⑤C E
E F可推断C为醇,则B为酸。⑥酸B
F可推断C为醇,则B为酸。⑥酸B D
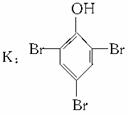
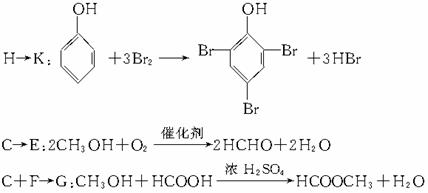
D C6H6O
C6H6O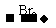 K↓(白)。这个条件是解题的难点。要深入理解甲烷实验室制法反应的原理。则认定C6H6O为苯酚,D为苯酚钠从而A为含苯环和酚羟基的酯。结构分子式推为
K↓(白)。这个条件是解题的难点。要深入理解甲烷实验室制法反应的原理。则认定C6H6O为苯酚,D为苯酚钠从而A为含苯环和酚羟基的酯。结构分子式推为
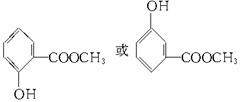
(不能为对位,因其一硝基取代物有四种)。
●命题趋向与应试策略
66.答案:(1)CH2==CH2+Cl2→CH2ClCH2Cl
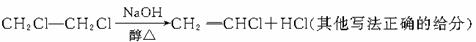
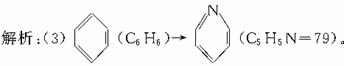
(2)C7H12 3 (3)79
64.答案:A、B的分子式中氢原子数相同,且相差n个碳原子,同时相差2n个氧原子(n?为正整数)(注:C、O原子数必须都答对)
C2H4O2 CH3COOH HCOOCH3
解析:由题意直接可得出A、B含H原子数一定相同。若二者都为烃,设A为CnHa,B为CmHa,则二者n与m不等时耗氧量一定不同,所以可以推论出A、B中或一为烃、一为含氧化合物或二者都含氧。又有燃烧1 mol碳原子一定消耗1 mol 氧气,所以B如比A多一个碳原子必须多含2个氧原子,这样保证二者耗氧气量相同。既相差n个碳原子;同时要相差2n个氧原子。若A为CH4,则B一定含O原子,按上述结论B相对分子质量最小时应比CH4多1个碳原子、2个氧原子即为C2H4O2。
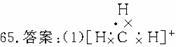
(2)120°
(3)(CH3)2CHOH
(4)(CH3)2C==CH2
解析:整理题给信息
①碳正离子是反应的中间体
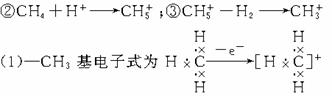
(2)与BF3、SO3等构型相似。推出键角为120°。
(3)由信息可推出中性分子在超强酸中可变为碳正离子,反之碳正离子在强碱溶液中即可结合OH-变为中性分子,反应式可简记为:
(CH3)2CH++OH- (CH3)2CHOH
(CH3)2CHOH
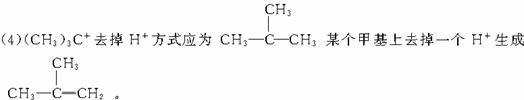
59.答案:(1)42 (2)3 (3)C9H8O4
解析:由A+H2O CH3COOH+B,知A+18=60+B,所以A、B相对分子质量相差60-18=42。B的相对分子质量不超过200-42=158。又A水解生成酸和B,则B含羟基,A含酯基,又A还显酸性且不使FeCl3显色,则A还原有羧基(-COOH),则B也应有羧基。故可初步推断B含3个氧原子,再由B中氧的质量分数,可求B的相对分子质量应为M(B)=
CH3COOH+B,知A+18=60+B,所以A、B相对分子质量相差60-18=42。B的相对分子质量不超过200-42=158。又A水解生成酸和B,则B含羟基,A含酯基,又A还显酸性且不使FeCl3显色,则A还原有羧基(-COOH),则B也应有羧基。故可初步推断B含3个氧原子,再由B中氧的质量分数,可求B的相对分子质量应为M(B)=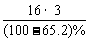 =138<158推断合理。由以上分析可知B为羟基苯甲酸。此题可解。
=138<158推断合理。由以上分析可知B为羟基苯甲酸。此题可解。
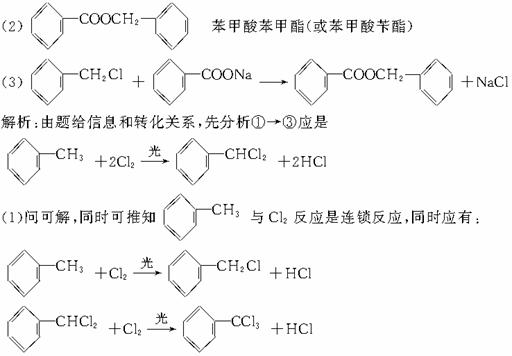
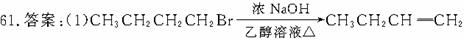
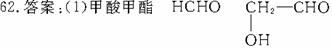
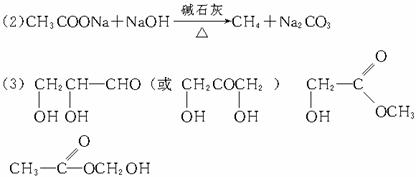
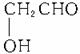 解析:(1)由n(C)∶n(H)∶n(O)=1∶2∶1,知A、B、C最简式为CH2O。都能发生银镜反应,即都含-CHO;都不水解,即都不为酯。又根据A的性质可推知A为甲醛(HCHO);B为乙酸,则B的分子式为C2H4O2,B2能发生银镜反应可推知为HCOOCH3(甲酸甲酯),则B只能为
解析:(1)由n(C)∶n(H)∶n(O)=1∶2∶1,知A、B、C最简式为CH2O。都能发生银镜反应,即都含-CHO;都不水解,即都不为酯。又根据A的性质可推知A为甲醛(HCHO);B为乙酸,则B的分子式为C2H4O2,B2能发生银镜反应可推知为HCOOCH3(甲酸甲酯),则B只能为
(2)B1为乙酸与Na2CO3反应生成CH3COONa(X),Y为最简单的烃为CH4,故可根据CH4的实验室制法得解。
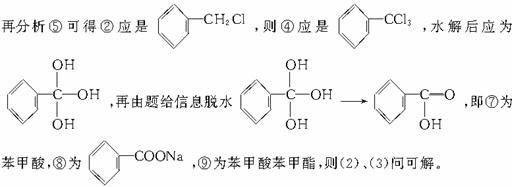
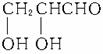 (3)C可设为(CH2O)n分解为Cn(H2O)n,而1 mol C与3 mol O2反应可知n=3,即C分子式为C3H6O3,又由上可知C含-CHO,不水解,可推为
(3)C可设为(CH2O)n分解为Cn(H2O)n,而1 mol C与3 mol O2反应可知n=3,即C分子式为C3H6O3,又由上可知C含-CHO,不水解,可推为
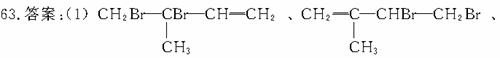
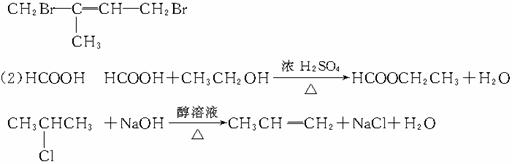
58.答案:(1)CxHy+(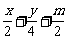 )O2===mCO2+
)O2===mCO2+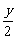 H2O+(x-m)CO
H2O+(x-m)CO
(2)C4H8
解析:(2)CxHy+(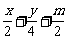 )O2
)O2
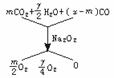
当m=2时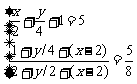
解得:x=4 y=8? 所以该烃为C4H8
(3)以下计算和讨论过程供参考:
固体质量总增重
ΔW=ΔW(CO2)+ΔW(H2O)+ΔW(CO)=28m+y+28(x-m)=28x+y
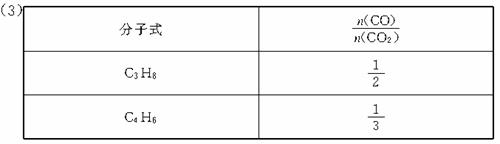
①根据Na2O2增重 90≤28x+y≤118讨论得气态烃中x=3时 y≥6,x=4时 y≤6?
此条件下合理的答案有:C4H6、C4H4、C3H8、C3H6
②根据燃烧产物通过足量Na2O2产生O2的体积都是3体积
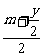 =3
因为x>m 所以x>6-
=3
因为x>m 所以x>6-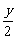
讨论得气态烃中x=3时 y>6,x=4时 y>4?
根据①②条件需同时满足,从而否定C4H4,否定C3H6。
所以该烃的可能性为C3H8与C4H6。
再根据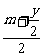 =3,
=3,
y=8时,m=2 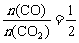
y=6时,m=3 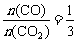
53.答案:(1)乙醚和乙醇,乙醚和水 (2)乙醚为7 mol,乙醇为2 mol
解析:(2)由题意,该混合物可写为C16H42O5,1 mol C16H42O5的质量=12 g×16+1 g×42+16 g×5=314 g,628 g÷314 g=2,即628 g混合物中含32 mol C,84 mol H和10 mol O,设628 g混合物中含a mol C4H10O和b mol C2H6O,并已知n(H2O)=1 mol。
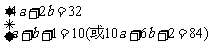
解之,得:a=7,b=2?
乙醚为7 mol, 乙醇为2 mol。
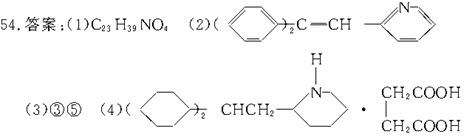
解析:由合成路线中④反应条件,结合所学知识可知,反应④应为消去反应,由此即可确定中间体(Ⅰ)的结构。如果⑤⑥两步颠倒,则中间体(Ⅰ)首先与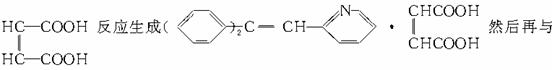 H2加成即生成:
H2加成即生成:
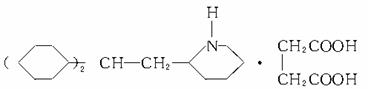
解析:此题应采用逆向推导。由反应②可知-NH2易被氧化,故该反应应在最后进行。
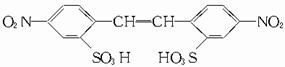
由此推知D为 由转化关系可知A→B应为
硝化反应,由B→C应为反应①,故由C→D应为反应③。从而再确定C的结构为
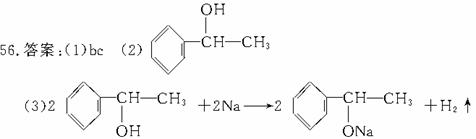
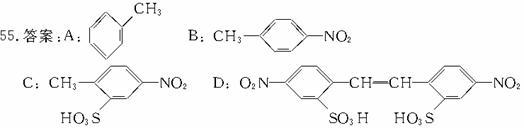
解析:由①和②可知A中含有-OH,再由③可知A含有苯环,且不含酚羟基,且苯环上只有一个侧链。又由④可知-OH不在侧链端碳原子上。综上条件即可推出A的结构为: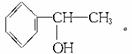
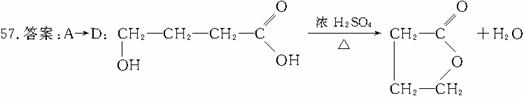
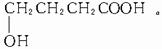 解析:由A的分子式为C4H8O3,且有酸性可知A含有-COOH;又知
解析:由A的分子式为C4H8O3,且有酸性可知A含有-COOH;又知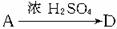 (五原子环化合物)可推知A为直链化合物且含有-OH位于端碳原子上,从而得出A的结构简式为
(五原子环化合物)可推知A为直链化合物且含有-OH位于端碳原子上,从而得出A的结构简式为
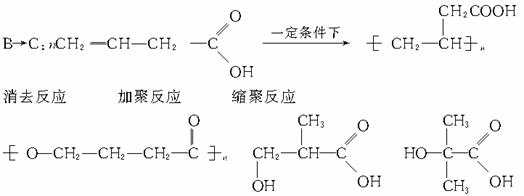
50.答案:
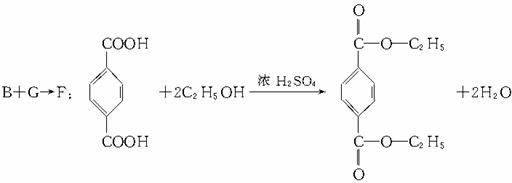
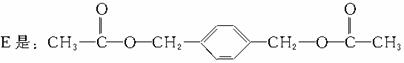
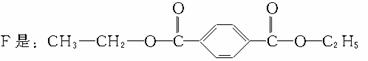
A:对苯二甲醇 B:对苯二甲酸,
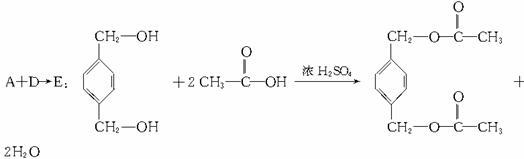
X:取代 光 ②④
解析:仔细分析框图,在反应条件的提示下确定各生成物的结构,是解答此题的关键。教材中对卤代烃与NaOH溶液的反应没有涉及,但本题已说明:E和F具有相同的相对分子质量,可推知:
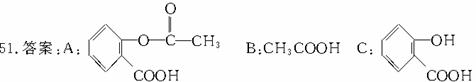
解析:有机物间在相互衍变时,除组成和性质上的衍变外,还包含有量的变化,而且量的变化往往是问题的突破口。本题就是定性和定量相结合进行有机推断的一个典例。
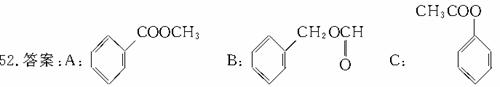
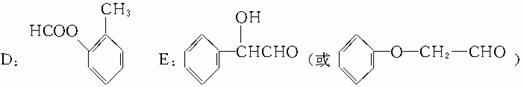
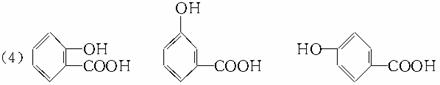
(说明:答案中A和B可以互换,C和D可以互换:D写成间位或对位均可)
解析:本题考查了同分异构体的书写方法。在书写有机物同分异构体时应注意三点:一是物质的类别,即物质中的官能团;二是物质的原子组成;三是由价键原则确定原子团之间的联接方式。如A为一种酯,必含有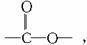 且含有苯环,再有分子式为C8H8O2,则还剩余原子团只能为-CH2-,最后由价键原则写出结构式。
且含有苯环,再有分子式为C8H8O2,则还剩余原子团只能为-CH2-,最后由价键原则写出结构式。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com