
浓硫酸除了具有酸的通性外,还具有吸水性、脱水性和强氧化性这三大特性。
(1) 吸水性:吸收游离的水。可作实验室的干燥剂(但不能干燥碱性气体和还原性气体)。
(2) 脱水性:把有机物中的氢、氧两种元素按水的比例脱去。如蔗糖中加入浓硫酸(注意吸水和脱水的区别)。
(3) 强氧化性:浓硫酸的强氧化性还可以与多种物质反应体现。
2H2SO4(浓)+Cu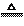 CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
2H2SO4(浓)+C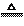 CO2↑+2H2O+2SO2↑
CO2↑+2H2O+2SO2↑
在常温下,浓硫酸跟铁、铝接触时,能在金属表面生成一薄层致密的氧化物,从而阻止内部的金属继续反应,这种现象叫钝化。因此可以用铁或铝贮存浓硫酸(硝酸也具有这一性质)。但是加热条件下可以反应。注意:常温下铁、铝使浓硫酸、浓硝酸钝化(钝化过程是复杂的化学变化),不能理解成“常温下铁、铝使浓硫酸、浓硝酸不发生化学反应”。
4.SO2的危害和治理
SO2是大气主要污染物,直接危害人类身体健康,酸雨为SO2产生的二次污染物。SO2的主要来源为燃烧含硫的燃料(如煤),消除SO2污染的最有效的途径是减少SO2的排放。
SO3是硫的最高价氧化物,为白色易挥发晶体,是典型的酸性氧化物
3. SO2的实验室制法:
|
反应原理 |
Na2SO3+
H2SO4== Na2SO4+ SO2↑+H2O(可加热提高反应速率) Cu+ 2H2SO4 (浓) 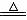 CuSO4+
SO2↑+2H2O CuSO4+
SO2↑+2H2O |
|
发生装置 |
固体与液体反应制取气体,发生装置与制Cl2相似 |
|
收集方法 |
向上排空气法 |
|
干燥 |
用浓H2SO4或P2O5酸性干燥剂(不可用碱石灰) |
|
尾气处理 |
用NaOH等碱溶液吸收多余的二氧化硫气体 |
2.SO2的化学性质:(1)具有酸性氧化物的通性:
(2)具有还原性:
(3)具有氧化性 其氧化性比氧气,氯气都弱。
(4)具有漂白性:漂白原理是 和HClO的漂白性的区别 。
★几种物质漂白原理的比较
|
|
SO2 |
氯水、H2O2、Na2O2、O3 |
活性炭 |
|
漂白原理 |
与有色物质结合生成无色物质 |
将有色物质氧化为无色物质 |
吸附有色物质 |
|
变化类型 |
化学变化 |
化学变化 |
物理变化 |
|
是否可逆 |
可逆,加热或日久后恢复原来颜色 |
不可逆,加热或日久后不恢复原来颜色 |
|
1.SO2的物理性质: 色有 气味 体, 毒 溶于水。
3.硫与氢气化合生成 ,生成的氢化物比水 (“稳定”还是“不稳定”)
2.汞与硫磺生成硫化汞,因此,实验室常将硫磺撒在汞的表面,以除去不慎洒落的汞。化学方程式为 ,硫的的化合价 (填“升高或降低”)
1.硫的可燃性:硫在纯净的氧气中燃烧现象 ,硫的化合价- (填“升高或降低”)
硫位于周期表 周期 族。淡黄色晶体,难溶于水,微溶于酒精,能溶于 。
6.若关于x的方程2cos2(p + x) - sinx + a = 0 有实根,求实数a的取值范围。
解:原方程变形为:2cos2x - sinx + a = 0 即 2 - 2sin2x - sinx + a = 0
∴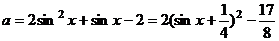
∵- 1≤sinx≤1
∴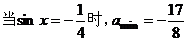 ;
; 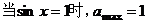
∴a的取值范围是[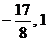 ]
]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com