
15. 下列说法或表示法正确的是( )
A.测定HCl和NaOH的中和热时,每次实验均应测量三个温度,即盐酸起始温度、NaOH起始温度和反应后的终止温度
B.由“C(石墨)-→C(金刚石);△H= +119 kJ/mol ”可知金刚石比石墨稳定
C.在稀溶液中: H++OH-=H2O;△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H= +285.8kJ/mol
[答案]AC
14. 有关键能数据如表
|
化学键 |
Si-O |
O=O |
Si-Si |
|
键能/kJ·mol-1 |
X |
498.8 |
176 |
晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)=SiO2(s);△H = -989.2/kJ·mol-1,则X的值为 ( )
A.423.3 B.460 C.832 D.920
[答案]B
13. 燃烧1g液态有机物,只生成0.05molCO2气体和1.2g液态水,且放出热量33.63kJ,该有机物的蒸汽对H2的相对密度为30,则该有机物燃烧的热化学方程式为( )
A.C3H8O(l)+9/2O2(g)=3CO2(g)+4H2O(l); △H=-2017.8kJ/mol
B.C3H8 (l)+5O2(g)=3CO2(g)+4H2O(l); △H=-33.63kJ/mol
C.C3H8(l)+5O2(g)=3CO2(g)+4H2O(l); △H=-1479.4kJ/mol
D.C3H8O(l)+9/2O2(g)=3CO2(g)+4H2O(g); △H=-2017.8kJmol
[答案]A
12. 一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知:
① CH4 (g)+4NO2 (g)=4NO (g) +CO2 (g)+2H2O (g) ;△H=―574 kJ·mol-1
② CH4 (g)+4NO (g)=2N2 (g)+CO2 (g)+2H2O (g) ;△H=―1160 kJ·mol一1。
下列选项正确的是( )
A.CH4 (g)+2NO2 (g)= N2 (g)+CO2 (g)+2H2O (l) ;△H=―867 kJ·mol-1
B.若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ
C.1molCH4催化还原NOx为N2的过程中,若x=1.6,则转移的电子为3.2 mol
D.若用标准状况下2.24L CH4还原NO2至N2,整个过程中转移的电子为0.8 mol
[答案]BD
11. 二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能;二甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ/mol;工业上用合成气(CO、H2)直接或间接制取二甲醚。下列叙述正确的是( )
A.二甲醚分子只含有极性共价键
B.二甲醚为可再生能源
C.以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是CH3OCH3-12e-+12OH-=2CO2+8H2O
D.二甲醚燃烧的热化学方程式表示为CH3OCH3(g)+3O2(g)→2CO2(g)+3H2O(g);ΔH=-1455 kJ/mol
[答案]A
10. 下列说法不正确的是 ( )
A.对于吸热反应,反应物所具有的总能量总是低于生成物所具有的总能量
B.任何放热反应在常湿条件下一定能发生反应
C.在稀溶液中,酸跟碱发生中和反应生成1molH2O时的反应热叫做中和热
D.在101kPa,1mol物质完全燃烧生成稳定氧化物时所放出的热量就叫做该物质的燃烧热
[答案]D
9. 2008年北京奥运会所用火炬燃料为丙烷(C3H8),悉尼奥运会所用火炬燃料为65%丁烷(C4H10)和35%丙烷(C3H8),已知丙烷的燃烧热为:2221.5kJ·mol-1,正丁烷的燃烧热为:2878kJ·mol-1,异丁烷的烯烧热为:2869.6kJ·mol-1,下列有关说法正确的是( )
A.奥运火炬燃烧时的能量转化主要是化学能转变为热能
B.相同质量的正丁烷和丙烷分别完全燃烧,前者需要的氧气多,产生的热也多
C.正丁烷比异丁烷稳定
D.丙烷燃烧的热化学方程式为:C3H8+5O2==3CO2+4H2O;△H=-2221.5kJ·mol-1
[答案]A
8. 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是( ) ①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0kJ·mol-1 ②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9kJ·mol-1 下列说法正确的是
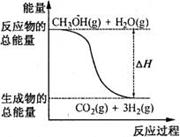 A.CH3OH的燃烧热为192.9kJ·mol-1
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)
A.CH3OH的燃烧热为192.9kJ·mol-1
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)
的△H>-192.9kJ·mol-1
[答案]D
7. 根据热化学方程式:S(g)+O2(g)=SO2(g);△H= -297.23kJ/mol。下列说法中正确的是 ( )
A.S(g)+O2(g)=SO2(l); |△H|>297. 3kJ/mol
B.S(g)+O2(g)=SO2(l);|△H|<297. 3kJ/mol
C.1mol SO2的键能总和小于1mol S和1mol O2键能之和
D.1mol SO2的键能总和等于1mol S和1mol O2键能之和
[答案]A
6. 在25℃、1.01×105Pa下,将22 g CO2通入1 mol·L-1NaOH溶液750mL中充分反应,测得反应放出x kJ热量。在该条件上,1 mol CO2通入2 mol·L-1NaOH溶液1 L中充分反应放出y kJ热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式是 ( )
A.CO2(g)+NaOH(aq) === NaHCO3(aq);△H=-(2y-x) kJ·mol-1
B.CO2(g)+NaOH(aq) === NaHCO3(aq);△H=-(2x-y) kJ·mol-1
C.CO2(g)+NaOH(aq) === NaHCO3(aq);△H=-(4x-y) kJ·mol-1
D.2CO2(g)+NaOH(1) === NaHCO3(1);△H=-(8x-2y) kJ·mol-1
[答案]C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com