
5.用4.35MnO2与过量浓盐酸反应,向反应后的溶液中加入10%的NaOH溶液40g,恰好中和过量的酸,再向溶液中加入过量的AgNO3溶液。求:
(1)标准状况下生成氯气的体积
(2)生成AgCl沉淀的质量
4.一块表面已被氧化为氧化钠的金属钠0.5g,投入100g水中,放出氢气224mL(标准状况),同时测得溶液的密度为1.09g/mL,求此溶液的物质的量浓度。
3.环境监测测定水中溶解氧的方法是:
(1)量取a mL水样迅速加入固定剂:MnSO4溶液和KI溶液(含KOH),立即塞好塞子,并振荡摇匀,使之充分反应。
(2)测定:开塞后迅速加入适量硫酸(提供H+),使之生成I2,再用b mol/L Na2S2O3滴定(与I2反应),消耗了V mL(以淀粉为指示剂),有关反应的离子方程式为:
①2Mn2++O2+4OH- 2MnO(OH)2(该反应极快)
2MnO(OH)2(该反应极快)
②MnO(OH)2+2I-+4H+ Mn2++I2+3H2O
Mn2++I2+3H2O
③I2+2S2O32- 2I-+S4O62-
2I-+S4O62-
试求:水中溶解的氧气的量(以g/L为单位).
2.有某二价金属氧化物和某三价金属氧化物的等物质的量组成的混合物,两者质量比为28:51,取这种混合物19.75g,恰好能与166mL浓度为20%、密度为1.10g/cm3的盐酸反应。试求这两种金属的相对原子质量。
1.200mL密度为1.1g/cm3的H2SO4,质量分数为15%跟Zn完全反应。计算:
(1)生成多少升氢气(标准状况)
(2)H2SO4物质的量浓度
(3)生成ZnSO4溶液,将此溶液稀释成0.50L,求此溶液物质的量浓度
15.(1)1s22s22p63s23p63d64s2 (2)角形(或V形) sp2 极性 (3)SiC 因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高。(4)12
[解析](1)根据周期表的图示,知
“O”为Fe。(2)k为S元素,燃烧产物为SO2,根据VSEPR可知,它有一对孤对电子,S原子为sp2杂化。(3)SiC和晶体Si均为原子晶体,熔沸点的比较则看原子半径,小的熔沸点高。(4)从晶胞看,应为金属堆积方式中的铜型,配位数为12,从图乙中知,一个晶胞中含有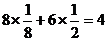 个原子,其质量为
个原子,其质量为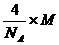 ;由丙图知,边长为
;由丙图知,边长为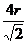 ,根据
,根据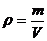 即可得出结果。
即可得出结果。
13.(l) 1s22s22p6 (2)π σ (3)小 b (4)Cu 6
[解析](1)N3-应与稀有气体Ne具有相同的电子排布式。(2)氮气分子中含有1个σ键与2个π键,根据题中提供的键能可得N-N π键为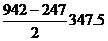 KJ·mol-1,故π键比σ键
KJ·mol-1,故π键比σ键 [解析]本题主要考查了晶胞中粒子的排布,不同晶体熔沸点的比较以及微粒间的作用力。(2)迁移考查NaCl晶胞中粒子的排列;(4)熔沸点的比较规律;(5)①比较σ、π间的区别;②氢键和配位键的表示方法不同,氢键用“……”,配位键用“→”表示。
[解析]本题主要考查了晶胞中粒子的排布,不同晶体熔沸点的比较以及微粒间的作用力。(2)迁移考查NaCl晶胞中粒子的排列;(4)熔沸点的比较规律;(5)①比较σ、π间的区别;②氢键和配位键的表示方法不同,氢键用“……”,配位键用“→”表示。
8.C [解析]从图上分析,①不可能为位于第二周期第ⅣA族,因为这样③后面的元素应为F,而F上面是不存在元素的,故A项错;②④位于同主族,从上至下,非金属性减弱,所对应的 气态氢化物的稳定性减弱,故B项错;④⑤位于同周期,从左向右,非金属性增强,所对应的最高价氧化物对应水化物酸性增强,C项正确;元素③应为F,而F没有最高正价,D项错。
气态氢化物的稳定性减弱,故B项错;④⑤位于同周期,从左向右,非金属性增强,所对应的最高价氧化物对应水化物酸性增强,C项正确;元素③应为F,而F没有最高正价,D项错。
 (4)NH3分子间能形成氢键,而As电负性小,半径大,分子间不能形成氢键。
(4)NH3分子间能形成氢键,而As电负性小,半径大,分子间不能形成氢键。
[解析]本题以第三代半导体砷化镓为背景,全面考查原子结构与性质、分子结构及晶体结构知识灵活掌握程度,另一方面通过LED推广使用形成节能减排价值取向和环境友好的消费情趣。这类试题常常是通过小背景作为生长点,融合物质的结构与性质大部分知识内容。
11.(1)S C (2)V形 直线形 SO2 因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大(3)Cr 四 1s22s22p63s23p63d54s1 +6 (4)F-H…F F-H…O O-H…F O-H…O
[解析]此题主要考查了电子排布式,分子的空间构型,分子的极性,“相似相溶”原理以及氢键的表示方法。题型属于推断式,首先要正确的推出所有元素,然后再回答相应问题。
12.(1)Al(OH)3+
OH-=AlO2- +2H2O(2)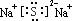 (3)酸 Al3++3H2O
(3)酸 Al3++3H2O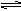 Al(OH)3+3H+
(4)SO2+Cl2+2H2O=H2SO4+ 2HCl(5)HCl>H2S (6)S2->Cl->Na+>Al3+ (7)Cl2O7(l)+H2O(l)=2HClO4(aq);△H=-4QkJmol-1
Al(OH)3+3H+
(4)SO2+Cl2+2H2O=H2SO4+ 2HCl(5)HCl>H2S (6)S2->Cl->Na+>Al3+ (7)Cl2O7(l)+H2O(l)=2HClO4(aq);△H=-4QkJmol-1
[解析]根据W、X、Y、Z是的同一短同期原子序数递增的元素,且W、X的最高价氧化物对应的水化物可以反应生盐和水,确定出W、X分别为Na和Al;由W与Y形成W2Y可以确定Y为S,Y的低价氧化物(SO2)与Z单质的水溶液反应可以确定Z为Cl,确定出四种元素其它的问题便迎刃而解。X的硝酸盐即Al(NO3)3属于强酸弱碱盐,水解显酸性。对于电子层结构相同的不同离子,核电荷数越小,离子半径越大,即S2- >Cl->Na+>Al3+;Z的最高价氧化物为Cl2O7,0.25mol与水反应放出QkJ热量,则1mol放出4QkJ的热量,可以写出对 应的热化学方程式。
应的热化学方程式。
7.B [解析]X、Y均为周期表的前20号元素,其简单离子的电子层结构相同,A项,对于阳离子,核外电子数为m-a,对于阴离子,核外电子数为n+b,故A项错; X2-与Y-电子层结构相同,则它们应位于同一周期,且X在Y的前面,Y的非金属性强于X,所对应的离子的还原性: X2->Y-,B项正确; S2-与Cl-电子层结构相同且位于同一周期,C项错误;X的原子半径大于Y,故X的非金属性弱于Y,其气态氢化物的稳定性也弱于Y,D项错误。
6.C [解析]T只有-2价,且原子半径小,所以T为O元素;R的最高正价为+6价,最低价为-2价,所以R为S元素;L的原子半径最大,化合价为+2价,所以L为Mg;M的原子半径介于Mg和S之间且化合价为+3价,所以M为Al;而Q的原子半径在Mg和O之间且化合价为+2价,所以Q为Be。选项A,由于H2O中存在氢键,所以沸点:H2T>H2R;选项B,由于Mg的金属性比Al强,所以与HCl反应的速率:L>Q;选项C,Al和Be的化合物具有两性;选项D,Mg2+只有两个电子层而S2-具有三个电子层。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com