
1.据报道,氢燃料电池公交汽车已经驶上北京街头。下列说法正确的是
A.电解水制取氢气是理想而经济的制氢方法
B.发展氢燃料电池汽车不需要安全高效的储氢技术
C.氢燃料电池汽车的使用可以有效减少城市空气污染
D.氢燃料电池把氢气和氧气燃烧放出的热能转化为电能
19.(13分)表中所列是周期表ⅥA族(氧族元素)的主要元素,表中内容为该族元素的部分性质。
|
性质/元素 |
8O |
16S |
34Se |
52Te |
|
单质熔点(℃) |
-218.4 |
113 |
|
452 |
|
单质沸点(℃) |
-183 |
444.6 |
685 |
1 390 |
|
主要化合价 |
-2 |
-2,+4+6 |
-2,+4, +6 |
 |
|
原子半径 |

|
|||
|
单质与H2反应情况 |
点燃易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
请根据表回答下列问题:
(1)硒的熔点范围可能是 。
(2)碲的化合价可能有 。
(3)氢硒酸有较强的 (填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为 。
(4)如图所示为氧族元素非金属单质与H2反应过程中的能量变化示意图,其中a、b、c、d分别表示氧族中某一元素的单质,ΔH为相同物质的量的单质与H2反应的反应热。则:b代表 ,d代表 (均写单质名称)。
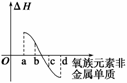
答案 (1)113℃-452℃ (2)-2、+4、+6 (3)还原性 2H2Se+O2 2H2O+2Se (4)硒 氧气
2H2O+2Se (4)硒 氧气



18.(12分)X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如图所示的变化:
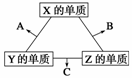
已知一个B分子中含有的Z元素的原子个数比C分子中的少一个。
请回答下列问题:
(1)X元素在元素周期表中的位置是 。
(2)X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入 (填物质名称);负极电极反应式为 。
(3)C在一定条件下反应生成A的化学方程式是 。
 (4)X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W溶液吸收生成一种盐。该盐的水溶液pH
7(填“大于”“小于”或“等于”),其原因是(用离子方程式表示):
。
(4)X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W溶液吸收生成一种盐。该盐的水溶液pH
7(填“大于”“小于”或“等于”),其原因是(用离子方程式表示):
。
答案 (1)第二周期,ⅥA族
(2)氧气 H2+2OH--2e- 2H2O
2H2O

(3)4NH3+5O2 4NO+6H2O
 (4)小于 NH
(4)小于 NH +H2O NH3·H2O+H+
+H2O NH3·H2O+H+
17.(11分)2008年5月22日,化工易贸网讯 为维护社会秩序,保障公共安全,确保北京奥运会及残奥会顺利进行,北京市人民政府决定对257种化学品实施管制。氮化钠(Na3N)就是其中的一种,它是科学家制备的一种重要的化合物,与水作用可产生NH3。

请根据材料完成下列问题:
(1)Na3N的电子式是 ,该化合物由 键形成。
(2)Na3N与盐酸反应生成 种盐,其电子式分别为 、 。
 (3)Na3N与水的反应属于
反应(填基本反应类型)。
(3)Na3N与水的反应属于
反应(填基本反应类型)。
(4)比较Na3N中两种粒子的半径:r(Na+) r(N3-)(填“>”、“=”或“<”)。
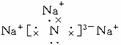
答案 (1) 离子
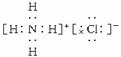
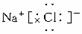
(2)2
(3)复分解
(4)<
16.(10分)(2008·全国理综Ⅱ改编,27)Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,Y和Z的离子与Ar原子的电子层结构相同且Y的原子序数小于Z。
(1)Q的最高价氧化物,其固态属于 晶体,俗名叫 ;
(2)R的氢化物分子的空间构型是 ,属于 分子(填“极性”或“非极性”);它与X形成的化合物可作为一种重要的陶瓷材料,其化学式是 ;
(3)X的常见氢化物的空间构型是 ;它的另一氢化物X2H4是一种火箭燃料的成分,其电子式是 。
(4)Q分别与Y、Z形成的共价化合物的化学式是 和 ;Q与Y形成的分子的电子式是 ,属于 分子(填“极性”或“非极性”)。
答案 (1)分子 干冰 (2)正四面体形 非极性 Si3N4
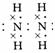
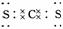
 (3)三角锥形 (4)CS2 CCl4
非极性
(3)三角锥形 (4)CS2 CCl4
非极性
15.(10分)揭示原子内部结构的奥秘,有助于理解我们所处的物质世界。
(1)图中元素f的氢化物的电子式是 ,此氢化物的热稳定性比元素g的氢化物的热稳定性 (填“强”或“弱”),元素f和g的性质有一定的变化规律,与其原子结构有关。
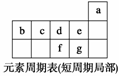
 (2)α粒子是
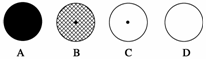
(填编号)原子所形成的一种粒子,1909年,卢瑟福等人用α粒子做了著名的实验,从而提出原子结构的行星模型,图中能正确表示这种模型的是
。
(2)α粒子是
(填编号)原子所形成的一种粒子,1909年,卢瑟福等人用α粒子做了著名的实验,从而提出原子结构的行星模型,图中能正确表示这种模型的是
。
答案 (1)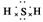 弱
弱
(2)a C
14.下图为元素周期表前四周期一部分,且X、Y、Z、R和W为主族元素。下列说法中正确的是 ( )
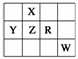
 A.五种元素一定都是非金属元素
A.五种元素一定都是非金属元素
B.五种元素的原子最外层电子数均大于2
C.X的氢化物的沸点一定比Z的氢化物的沸点高
D.R的最高价氧化物对应的水化物一定是强酸
答案 B
13. a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为
,b、c化合物
a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为
,b、c化合物
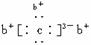
的电子式为 ,下列比较中正确的是 ( )
A.原子半径:a>c>b B.原子的氧化性:a>c>d
C.最高价氧化物的熔点:a>d>b D.最高价含氧酸的酸性:c>d>a
答案 D
12.砹是核电荷数最大的卤族元素,推测砹及其化合物最不可能具有的性质是 ( )
A.HAt很不稳定 B.砹是白色固体 C.AgAt不溶于水 D.砹易溶于某些有机溶剂
答案 B
11.下列关于碱金属元素的原子结构和性质的叙述不正确的是 ( )
 A.碱金属原子最外层都只有1个电子,在化学反应中容易失去
A.碱金属原子最外层都只有1个电子,在化学反应中容易失去
B.碱金属单质都是强还原剂
C.碱金属单质都能在氧气里燃烧生成过氧化物
D.碱金属单质都能与水反应生成碱
答案 C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com