
6.结晶: 。结晶水合物: 。结晶水合物容易失去结晶水,常见的结晶水合物有:
如胆矾( )、绿矾( )、明矾( )、石膏( )、芒硝( )等。
5.溶解度曲线: 。
(1)溶解度曲线上的点表示物质 ,溶液所处的状态 。
(2)溶解度曲线下面的的点,表示溶液所处的状态是 状态。
(3)溶解度曲线上面的点,依其数据配制的溶液为对应温度时的 溶液,且该溶质有剩余。
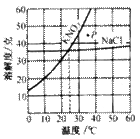 (4)两条溶解度曲线的交点,表示在该点所示的温度下,两种物质的 相等。
(4)两条溶解度曲线的交点,表示在该点所示的温度下,两种物质的 相等。
如:右图为硝酸钾和氯化钠的溶解度曲线。由图可知:
①当温度______时,硝酸钾与氯化钠的溶解度相等。
②当温度______时,氯化钠的溶解度大于硝酸钾的溶解度。
③图中P点表示KNO3对应的溶液是______
④当温度为10℃时,硝酸钾的溶解度是______ 。
4.固体溶解度:一定温度下,某物质在100g 里形成 时所溶解溶质的 。溶解度通常用S表示,单位为 。其数学表达式: 。
一般用固体物质在25℃时的溶解度大小来衡量其溶解性:
易溶 ,可溶 ,微溶 ,不溶 。
3.溶质的质量分数:用 溶液中所含溶质的 表示的浓度。
溶质的质量分数通常用ω表示,其数学表达式为 : 。
配制一定溶质的质量分数的溶液的操作步骤为① ② ③ 。现欲配制100g质量分数为10%的的NaOH溶液,需用到的实验仪器有 、
、 、 (必要时需注明仪器规格)。
2.饱和溶液:一定 下,一定量溶剂中不能 的溶液。溶液是否饱和是相对的,改变 、 、 等因素,不饱和溶液与饱和溶液可以相互转变。
1.溶液:一种或几种物质 到另一种物质里,形成 、 的混合物。
溶液由 、 组成。
3.对于化学平衡的有关图象问题,可按以下的方法进行分析:
(1)认清坐标系,搞清纵、横坐标所代表的意义,并与勒沙特列原理挂钩。
(2)紧扣可逆反应的特征,搞清正反应方向是吸热还是放热,体积增大还是减小、不变,有无固体、纯液体物质参加或生成等。
(3)看清速率的变化及变化量的大小,在条件与变化之间搭桥。
(4)看清起点、拐点、终点,看清曲线的变化趋势。
(5)先拐先平。例如,在转化率-时间图上,先出现拐点的曲线先达到平衡,此时逆向推理可得该变化的温度高、浓度大、压强高。
(6)定一议二。当图象中有三个量时,先确定一个量不变再讨论另外两个量的关系。
 试题枚举
试题枚举
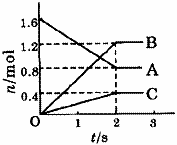
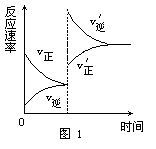
[例1]某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图1所示,则该反应的化学方程式为_________,2s内用A的浓度变化和用B的浓度变化表示的平均反应速率分别为_________、_________。
解析:这类题目是讨论同一时间段内各物质的变化量的比例关系,且要注意物质的量减少的为反应物,物质的量增多的为生成物。又因物质的量都不变时,反应物、生成物共存,故方程式要用“ ”表示。
”表示。
答案:2A 3B+C;0.08mol/(L·s);0.12mol/(L·s)。
3B+C;0.08mol/(L·s);0.12mol/(L·s)。
[例2] 对达到平衡状态的可逆反应X+Y Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图1所示,则图象中关于X、Y、Z、W四种物质的聚集状态为
Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图1所示,则图象中关于X、Y、Z、W四种物质的聚集状态为
 A.Z、W均为气体,X、Y中有一种是气体
A.Z、W均为气体,X、Y中有一种是气体
B.Z、W中有一种是气体,X、Y皆非气体
C.X、Y、Z、W皆非气体
D.X、Y均为气体,Z、W中有一种为气体
解析: 经常有一些同学错选B,认为增大压强,平衡向气体体积缩小的方向移动.其实,图象告诉我们的是:增大压强,加快了正、逆反应,但逆反应速率增大的幅度大于正反应速率增大的幅度,由此而导致平衡向左移动.而压强的改变,只影响气体反应的速率,选项B所言的X、Y皆非气体即其正反应速率不受影响,故正确答案为A.
答案:A
[例3]下列各图是温度(或压强)对应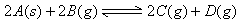 ;
; 的正、逆反应速率的影响,曲线交点表示建立平衡时的温度或压强,其中正确的是
的正、逆反应速率的影响,曲线交点表示建立平衡时的温度或压强,其中正确的是
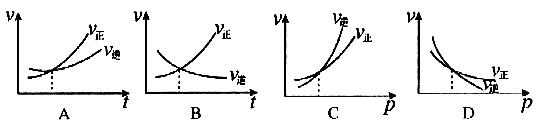
解析:曲线交点表示建立平衡时的温度或压强,升高温度,增加压强,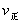 、
、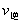 均增大,B中
均增大,B中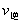 ,D中
,D中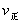 、
、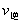 走向均减小,则B、D均错;可逆反应
走向均减小,则B、D均错;可逆反应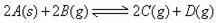 ;
;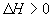 的正反应是一个气体体积增大的吸热反应,则升高温度,向正反应方向移动,故
的正反应是一个气体体积增大的吸热反应,则升高温度,向正反应方向移动,故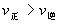 ;增加压强,向逆反应方向移动,故
;增加压强,向逆反应方向移动,故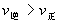 。
。
答案:A、C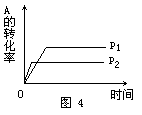
[例4] 现有可逆反应A(g)+2B(g) nC(g)+Q,在相同温度、不同压强时,A的转化率跟反应时间(t)的关系如图4,其中结论正确的是 [ ].
nC(g)+Q,在相同温度、不同压强时,A的转化率跟反应时间(t)的关系如图4,其中结论正确的是 [ ].
A.p1>p2,n>3 B.p1<p2,n>3
C.p1<p2,n<3 D.p1>p2,n=3
解析: 当其他条件不变时,对于有气体参加的可逆反应,压强越大,到达平衡的时间越短.图象中曲线和横轴平行,表明反应已达平衡.由图象知道,当压强为p2时,该反应到达平衡的时间较短,故p1<p2.在其他条件不变的情况下,增大压强会使化学平衡向着气体体积缩小的方向移动.因p1<p2,且当压强为p1时,A的转化率较大,所以正反应为气体体积增加的反应,即1+2<n,故正确答案选B。
答案:B
2.对于化学反应速率的有关图象问题,可按以下的方法进行分析:
(1)认清坐标系,搞清纵、横坐标所代表的意义,并与有关的原理挂钩。
(2)看清起点,分清反应物、生成物,浓度减小的是反应物,浓度增大的是生成物一般生成物多数以原点为起点。
(3)抓住变化趋势,分清正、逆反应,吸、放热反应。升高温度时,v(吸)>v(放),在速率-时间图上,要注意看清曲线是连续的还是跳跃的,分清渐变和突变,大变和小变。例如,升高温度,v(吸)大增,v(放)小增,增大反应物浓度,v(正)突变,v(逆)渐变。
(4)注意终点。例如在浓度-时间图上,一定要看清终点时反应物的消耗量、生成物的增加量,并结合有关原理进行推理判断。
1.牢固掌握有关的概念与原理,尤其要注意外界条件的改变对一个可逆反应来讲,正逆反应速率如何变化,化学平衡如何移动,在速度-时间图、转化率-时间图、反应物的含量-浓度图等上如何体现。要能够画出有关的变化图象。
2.能够通过对图形、图表的观察,获取有关的感性知识和印象,并对这些感性知识进行初步加工和记忆
知识梳理
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com