
2.生产决定消费,消费对生产具有反作用。下列选项中体现消费对生产具有重要反作用的是 ( )
A.数字技术的发展,为人们提供了视听效果更完美的产品
B.随着收入水平的不断提高。旅游成为人们生活的一部分
C.网上购物方式不仅方便了消费者,而且降低了企业成本
D.人们对健康的关注,推动了绿色食品业的迅速发展
1.社会生产过程由许多生产要素参与。其中最重要最活跃的要素是 ( )
A.劳动者的劳动 B.科学技术
C.以土地为代表的自然资源 D.资本
20.(14分)将23.9g表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片投入120mL一定浓度的硝酸中;充分反应后,硝酸被还原成NO2和NO,测得反应后溶液PH值为1。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤,干燥后得到29.4g蓝色固体。(假设反应前后溶液的体积不变)
计算:(1)已锈蚀的铜片中的铜元素的质量分数为 ▲ 。(保留两位小数)
(2)求铜片中单质铜的物质的量。(写出计算过程)
(3)若生成NO2和NO混合气体共aL(标准状况)。
①a的取值范围为 ▲ 。
②原硝酸的浓度为多少?(只需用a的代数式表示,写出过程)
19.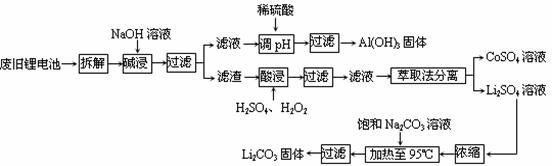 (14分)2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2)、导电乙炔黑(一种炭黑)、铝箔以及有机粘接剂。某回收工艺流程如下:
(14分)2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2)、导电乙炔黑(一种炭黑)、铝箔以及有机粘接剂。某回收工艺流程如下:
(1)上述工艺回收到的产物有 ▲ 。
(2)废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是_____ ▲ __________。
(3)碱浸时主要反应的离子方程式为________ ▲ _____。
(4)酸浸时反应的化学方程式为____ ▲ _______。如果用盐酸代替H2SO4和H2O2的混合液也能达到溶解的目的,但不利之处是____ ▲ ___________。
(5)生成Li2CO3的化学反应方程式为___ ▲ _________。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应___ ▲ _________。
18.(12分)我国在航天事业上取得了令世界瞩目的成就,神舟飞船多次被长征系列火箭送入太空。
⑴长征二号捆绑式火箭推进剂以联氨(N2H4)作为燃料,N2O4作为推进剂。
①N2O4的主要作用是助燃,但其在工作时会产生红棕色气体NO2,对环境会造成污染,为避免污染可使用下列 ▲ (填字母)代替之。
A.液态氨 B.H2O2 C.KMnO4 D.液态氧
②在碱性条件下,用尿素[CO(NH2)2]和次氯酸钠反应可以制取联氨(产物中同时有两种正盐),则该反应的离子方程式是 ▲ 。
⑵飞船座舱内空气的更新过程如下图所示:
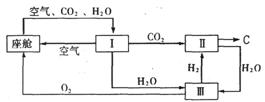
①座舱内空气更新过程可以循环利用的物质为H2、O2和 ▲ ;装置Ⅱ中发生反应的化学方程式为 ▲ 。
②从装置Ⅰ、Ⅱ、Ⅲ可看出O2的来源,若宇航员每天消耗35 mol02,每天呼出的气体中含18 mol H2O,则呼出的气体中含CO2 ▲ mol。
17.(14分)复印机使用的墨粉主要成分是Fe3O4,下图是氧化沉淀法生产Fe3O4的工艺:
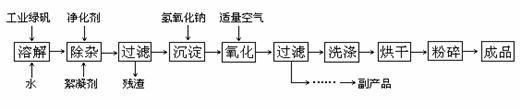
已知:① 工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应;
② Fe(OH)2+2Fe(OH)3=Fe3O4·4H2O
请回答下列问题:
(1)铁的常见氧化物有 ▲ ;
(2)Fe3O4与稀硝酸反应的离子方程式是 ▲ ,
检验反应后的溶液中含Fe3+的方法 ▲ ;
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是: ▲ ;
(4)生产中可获得的副产品是 ▲ ,提取该副产品的操作顺序是 ▲ (填写序号)
a.过滤 b.加热浓缩 c.冷却 d.结晶 e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16 kg/h,为使产品较纯,鼓入空气的速率应为 ▲ m3/h(假设反应在标准状态下进行,空气中O2占20%)。
16.(12分)五羰基合铁[Fe(CO)5]是一种浅黄色液体,熔点-20.5℃,沸点103℃,易溶于苯等有机溶剂,不溶于水,密度1.46-1.52g/cm3,有毒,光照时生成Fe(CO)9,60℃发生自燃,可用作汽油防爆剂,阻燃剂,催化剂等。五羰基合铁的制备原理如下:
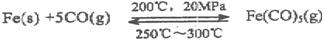
(1)五羰基合铁中铁的化合价为 ▲ 。
(2)下列说法正确的是 ▲ 。
A.利用上述反应原理可制备高纯铁
B.制备Fe(CO)5应在隔绝空气的条件下进行
C.反应Fe(s)+5CO(g)  Fe(CO)5(g)的平衡常数表达式为
Fe(CO)5(g)的平衡常数表达式为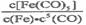
D.Fe(CO)5应密封、阴凉、避光并加少量蒸馏水液封贮存
(3)五羰基合铁能与氢氧化钠溶液反应生成Na2Fe(CO)4和另两种常见无机物,该反应的化学方程式为 ▲ 。
(4)今将一定量的Fe(CO)5的苯溶液,用紫外线照射片刻。取照射后的溶液11.72g完全燃烧,得到30.53gCO2、5.4gH2O及1.6g红棕色粉末。
①红棕色粉末的化学式为 ▲ 。
②照射后的溶液中Fe(CO)5和Fe(CO)9的物质的量之比为 ▲ 。
15.(14分)纯净的过氧化钙(CaO2)难溶于水、乙醇,常温下较为稳定。CaO2·8H2O在0℃时稳定,加热至130℃时逐渐变为无水CaO2。在实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。其制备过程如下:
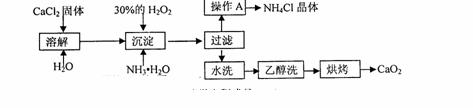
根据以上信息,同答下列问题:
(1)用上述方法制取CaO2·8H2O的化学方程式是 ▲ ;
(2)操作A的步骤为 ▲ ;
(3)检验“水洗”已经洗净的方法是 ▲ ;
(4)测定产品中CaO2的含量的实验步骤是(己知:I2+2S2O32-=2I-+S4O62-):
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI品体,再滴入适量2 mol·L-1的H2SO4溶液,充分反应:
第二步:向上述锥形瓶中加入几滴淀粉溶液:
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。
①第三步反应完全时的现象为 ▲ ;
②产品中CaO2的质量分数为 ▲ (用字母表示);
③某同学经实验测得产品中CaO2的质量分数偏高,造成偏高的原因是(测定过程中由操作产生的误差忽略不计,用离子方程式表示) ▲ 。
14、将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产生全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是
A.开始加入合金的质量可能为6.4g
B.参加反应的硝酸的物质的量为0.1mol
C.生成沉淀完全时消耗NaOH溶液的体积为100mL
D.溶解合金时收集到NO气体的体积为2.24L
非选择题(共78分)
13.工业上进行下列物质的制取,其所示的物质的转化关系中,正确的是
A.以食盐为原料制Na2CO3:
2NaCl+2H2O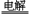 2NaOH+H2↑+Cl2↑;2NaOH+CO2=Na2CO3+H2O
2NaOH+H2↑+Cl2↑;2NaOH+CO2=Na2CO3+H2O
B.以铜和硫酸为原料制取硫酸铜:
2Cu+O2 2CuO CuO+H2SO4=CuSO4+H2O
2CuO CuO+H2SO4=CuSO4+H2O
C.从海水中提取MgCl2:
MgCl2+2NaOH=Mg(OH)2↓+2NaCl Mg(OH)2+2HCl=MgCl2+H2O
D.黄铁矿为原料制硫酸:
4FeS+7O2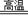 2Fe2O3+4SO2;2SO2+O2
2Fe2O3+4SO2;2SO2+O2 2SO3;SO3+H2O=H2SO4
2SO3;SO3+H2O=H2SO4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com