
【题目】某研究性课题小组对氢氧化钠溶液和稀盐酸中和反应的有关问题,进行了如下探究:
I:(1)甲同学为了证明氢氧化钠溶液与稀盐酸能够发生反应,设计并完成了如图1所示实验,则X是_____溶液。
(2)乙同学用传感器探究稀NaOH溶液与稀盐酸反应过程中温度和pH的变化测定结果
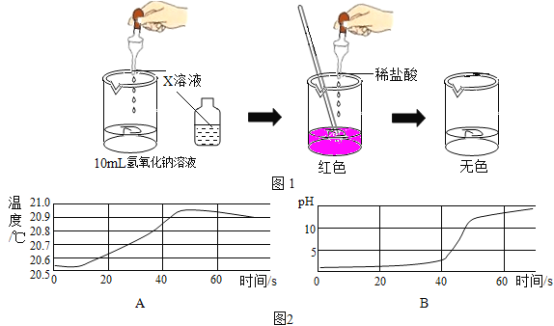
如图2所示。通过分析可知,稀NaOH溶液与稀盐酸反应会_____(填“放出”或“吸收”)热量。60s 时,溶液中的阴离子为_____(写离子符号)。
Ⅱ:丙同学为了验证上述实验,也将盐酸滴入某氢氧化钠溶液中,发现有气泡产生,他认为该氢氧化钠溶液已经变质,原因用化学方程式可表示为_____。
为了测定该氢氧化钠溶液中碳酸钠的质量分数,丙同学设计了如图3所示的实验装置。已知分液漏斗中装有10%的稀盐酸,装置内试剂均足量。
[实验步骤]①按如图3连接好装置后,并检查装置气密性;
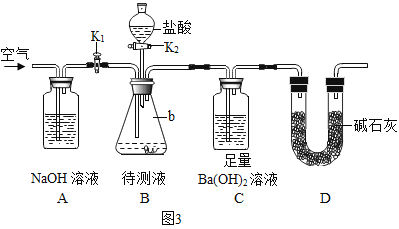
②关闭K1和K2,向B装置中加入100.0g 该氢氧化钠溶液样品(忽略原装置内空气中二氧化碳对实验的影响) ;
③打开K2,向锥形瓶内滴加盐酸,直到B中不再产生气泡为止;
④打开K1关闭K2, 通入一段时间空气,至装置C中不再产生沉淀为止;
[实验分析]①A装置的作用是_____。
②若缺少步骤④,则测定结果将_____(填“偏大”、“偏小”或“不变”)。
[实验反思]①有同学提出,图3装置不变,可以分别称量装置C反应前后的质量,其差量为装置B中反应生成的二氧化碳质量,经进一步计算可求得碳酸钠的质量分数,你是否同意该同学的意见?_____( 填“同意”或“不同意”)。
②下列各项措施中,能提高测定准确度的是_____(填字母序号)
A 缓缓滴加稀盐酸
B 增加盐酸的浓度
C 把稀盐酸换成稀硫酸
D 在装置B、C之间先后增加盛有饱和NaHCO3和浓硫酸的洗气瓶
[定量分析]改进装置后,将装置C中的固液混合物过滤、洗涤、烘干后称得固体质量为3.94g。 计算该氢氧化钠溶液中碳酸钠的质量分数。_____(写出计算过程)。
【答案】酚酞 放出 ![]()
![]() 除去空气中的二氧化碳气体 偏小 不同意 A 2.12%
除去空气中的二氧化碳气体 偏小 不同意 A 2.12%
【解析】
氢氧化钠溶液与稀盐酸反应生成氯化钠和水,氢氧化钠变质的原因是吸收了空气中的二氧化碳,同时生成碳酸钠和水,稀硫酸和碳酸钠反应生成硫酸钠、水和二氧化碳。
I:(1)氢氧化钠溶液与稀盐酸反应生成氯化钠和水,图1酸碱中和反应的颜色变化,溶液先变红再变无色是用了指示剂的原因,在氢氧化钠溶液中变红的指示剂为酚酞试液,故X是酚酞溶液。
(2)由图2可知,随着反应的进行,在反应结束前,温度是逐渐升高的,故稀NaOH溶液与稀盐酸反应会放出热量;在反应进行中,溶液的pH值小于7逐渐到大于7,得出此反应是往盐酸溶液中逐渐滴加氢氧化钠溶液,在约45秒时,溶液pH=7,反应恰好完全,60s 时,氢氧化钠溶液过量,溶液中的阴离子为氯离子,氢氧根离子,离子符号为![]() 。
。
Ⅱ:氢氧化钠变质的原因是吸收了空气中的二氧化碳,同时生成碳酸钠和水,反应的化学方程式为![]() 。
。
[实验分析]
①此实验是B装置产生的二氧化碳鼓入C装置完成实验及数据的测定。为了使B装置产生的二氧化碳全部进入C装置,用空气促使气体进入,而空气中的二氧化碳会影响到C装置的数据测定。故A装置的作用是除去空气中的二氧化碳气体。
②若缺少步骤④,即反应停止后就停止通入空气,则反应生成的二氧化碳无法全部进入吸收装置C,测得二氧化碳的质量会偏小,测得碳酸钠的质量会偏小。
[实验反思]
①盐酸具有挥发性,二氧化碳气体中可能含有氯化氢气体,会导致装置C中的质量增加,求得碳酸钠的质量分数偏大,故不同意。
②A、缓缓滴加稀盐酸,可以避免反应太块,导致生成的二氧化碳气流流速过快,引起二氧化碳不充分吸收,可以提高准度,故A正确;
B、增加盐酸的浓度,会挥发出氯化氢气体,反应速率加快,导致生成的二氧化碳气流流速过快,不能提高准度,故B不正确;
C、稀硫酸和碳酸钠反应生成硫酸钠、水和二氧化碳,反应速率较快,导致生成的二氧化碳气流流速过快,不能提高准度,故C不正确。
D、挥发出来的HCl进入盛有NaHCO3溶液的洗气甁,NaHCO3+HCl=NaCl+H2O+CO2↑使得生成的二氧化碳偏多,造成误差,不可以提高准度,故D不正确。故选A。
[定量分析]
设碳酸钠的质量为x
由化学方程式![]() 可知:
可知:
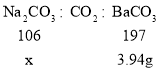
![]()
![]()
该氢氧化钠溶液中碳酸钠的质量分数为:![]() 。
。


科目:初中化学 来源: 题型:
【题目】煤的气化是一种重要的煤炭资源综合利用技术,其过程如图I所示。合成气中的物质A和B在一定条件下发生反应生成了物质C和D,其微观过程如图II所示:
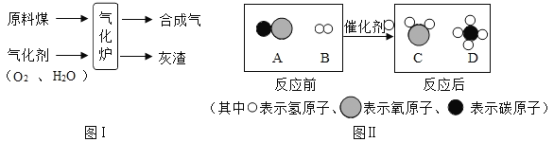
(1)煤属于____________________ (填“再生”或“不可再生”)能源;传统的燃料大多来自于化石燃料,如煤、___________和天然气。
(2)图I气化炉中发生的变化________________________________(填“物理”或“化学”)变化。.
(3)图IIA,B, C, D四种物质中,常温时呈气态的氧化物为________________________________(填化学式)。
(4)物质D不仅是一种清洁能源,也是重要的化工原料。写出物质D燃烧的化学方程式:____________________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下图回答问题。

(1)溴是__(填“金属”或“非金属”)元素,其相对原子质量是___;
(2)D粒子的符号为__;
(3)C~F中化学性质相似的粒子是___(填字母序号);
(4)钠与溴形成化合物的化学式为__。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示为甲、乙、丙三种固体物质的溶解度曲线。下列说法不正确的是()
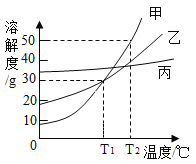
A.T2℃时,取等质量的甲、乙分别配制成饱和溶液,所需水的质量:甲>乙
B.T2℃时将甲、乙的饱和溶液均降温到T1℃,得到的溶液仍饱和
C.若甲中混有少量的丙,可采用降温结晶的方法提纯甲
D.T1℃时,甲、乙各30g分别加入100g水中,均形成饱和溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2011年5月1日起,国家加大了对醉酒驾驶的处罚力度。酒中都含有乙醇,其化学式C2H5OH。下列叙述中正确的是
A.乙醇属于氧化物
B.乙醇中碳、氢、氧元素的质量比为24:5:16
C.乙醇的相对分子质量为46
D.1个乙醇分子中含有3个氢分子
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有A、B两种银白色的金属,某同学想要探究这两种金属的活动性
(设计实验)
取大小相同的两块金属,用砂纸打磨光亮,分别放入两支试管中再加入等量的同种稀盐酸,操作与现象如表:
实验 | 试管1 | 试管2 |
操作 |
|
|
现象 | 金属表面产生气泡较慢 | 金属表面产生气泡较快 |
(思考结论)
(1)通过上述实验,判断出两种金属的活动性顺序是A _____B(填“>”或“<”)。
(2)假设金属B是铝,写出其中发生反应的化学方程式_____。
(3)实验前用砂纸打磨金属片的目的是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氢气作为新能源有很多优点,制取与储存氢气是氢能源利用领域的研究热点。
Ⅰ.制氢:①![]() ②
②![]()
Ⅱ.贮氢:③![]() 。
。
下列说法不正确的是
A.反应②中 ZnFe2O4中的铁元素的化合价为+3
B.反应①为分解反应,反应②③是置换反应
C.该制氢的不足之处是:反应需温度较高,消耗大
D.熔炼制备Mg2Cu合金时,需要通入氩气,目的是防止镁、铜在高温下与氧气反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】炼铁厂常以焦炭、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,反应过程如下:
![]()
(1)写出②反应的化学方程式________;
(2)③发生还原反应的物质是__;
(3)反应完全结束后,检验所得固体中含有铁的最简单方法是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以下是实验室制取、收集、干燥、存放气体的装置图,有关说法错误的是
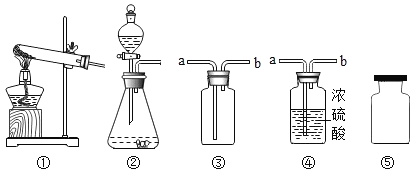
① ② ③ ④ ⑤
A. 实验室用双氧水制取氧气,用石灰石和稀盐酸制取二氧化碳均可使用装置②
B. 实验室收集氧气和二氧化碳均可使用装置③,气体从导管b进入
C. 实验室干燥氧气和二氧化碳均可使用装置④,气体从导管a进入
D. 实验室收集的氧气和二氧化碳,均可如图⑤临时存放
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com