
| 加入的氢氧化钠溶液的质量/g | 40 | 80 | 120 | 160 |
| 生成沉淀的质量/g | 0 | 9.8 | 19.6 | 19.6 |
分析 (1)根据表中数据分析产生沉淀的质量;
(2)根据氢氧化铜的质量结合方程式求解硫酸铜的质量,进一步计算废水中硫酸铜的溶质质量分数;
(3)由表中数据可知每40g氢氧化钠溶液与硫酸铜反应生成沉淀9.8g,所以前40g氢氧化钠溶液与硫酸反应,根据氢氧化钠的质量计算硫酸的质量;
(4)分别计算硫酸与Ba(OH)2溶液恰好反应的沉淀质量和所用Ba(OH)2溶液质量以及硫酸铜与Ba(OH)2溶液恰好反应的沉淀质量和所用Ba(OH)2溶液质量,描点连线.
解答 解:(1)根据表中数据分析产生沉淀的质量为19.6g;
(2)设200g废水中CuSO4的质量为x
CuSO4+2NaOH═Cu(OH)2↓+Na2SO4
160 98
x 19.6 g
$\frac{160}{x}$=$\frac{98}{19.6g}$
x=32 g
废水中硫酸铜的溶质质量分数为$\frac{32g}{200g}$×100%=16%;
答:废水中硫酸铜的溶质质量分数为16%.
(3)由表中数据可知每40g氢氧化钠溶液与硫酸铜反应生成沉淀9.8g,所以前40g氢氧化钠溶液与硫酸反应.
设废水中硫酸的质量为y
H2SO4+2NaOH=Na2SO4+2H2O
98 80
y 40g×20%
$\frac{98}{y}$=$\frac{80}{40g×20%}$
y=9.8g
答:废水中硫酸的质量为9.8g;
(4)设废液中硫酸与Ba(OH)2溶液恰好反应的硫酸钡质量为n,所用Ba(OH)2溶液质量m
H2SO4+Ba(OH)2═BaSO4↓+2H2O
98 171 233
9.8 g m×17.1% n
$\frac{98}{9.8g}$=$\frac{171}{m×17.1%}$=$\frac{233}{n}$
m=100g
n=23.3g
设废液中硫酸铜与Ba(OH)2溶液恰好反应的硫酸钡质量为a,氢氧化铜质量为b,所用Ba(OH)2溶液质量为c.
CuSO4+Ba(OH)2═BaSO4↓+Cu(OH)2↓
160 171 233 98
32 g c×17.1% a b
$\frac{160}{32g}$=$\frac{171}{c×17.1%}$=$\frac{233}{a}$=$\frac{98}{b}$
a=46.6g,
b=19.6g,
c=200g
氢氧化钡与废液中的硫酸和硫酸铜反应完全时,生成沉淀为
23.3 g+46.6 g+19.6 g=89.5 g
消耗Ba(OH)2溶液质量为100 g+200 g=300 g
所以加入Ba(OH)2溶液的质量与产生沉淀的质量的关系图为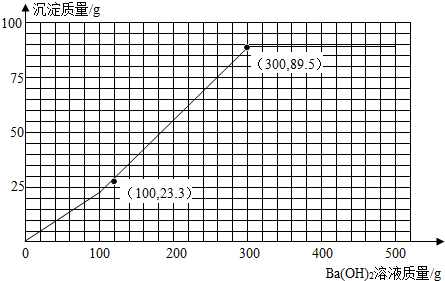
故答案为:(1)19.6g;
(2)16%;
(3)9.8g;
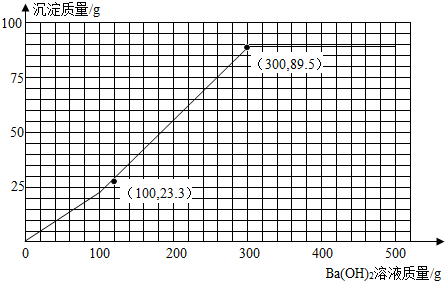
(4)
点评 本题是一道综合性很强的根据化学方程式计算,只要找准已知量和相应未知量是解答此类题目的关键所在,关于作图要找准起始点和折点即可.


 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 炒菜时油锅着火,立即用锅盖盖灭 | B. | 用水可以溶解食盐、白糖、油脂等 | ||
| C. | 用煮沸的方法可以使硬水软化 | D. | 用活性炭可去除冰箱里的异味 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
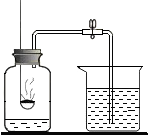 如图是初中化学的一个常见实验,该实验的目的是空气中氧气含量的测定,如果取用红磷的量偏多,则实际测得的实验结果将不变(填“偏大”、“偏小”或“不变”).
如图是初中化学的一个常见实验,该实验的目的是空气中氧气含量的测定,如果取用红磷的量偏多,则实际测得的实验结果将不变(填“偏大”、“偏小”或“不变”).查看答案和解析>>
科目:初中化学 来源: 题型:推断题
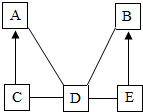 A、B、C、D、E是初中化学中常见的不同类别的物质,已知A是单质;C是红棕色固体;E是水溶液可使酚酞试液变为红色的盐,图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质可制得另一物质(部分反应物、生成物及反应条件已略去),回答下列问题:
A、B、C、D、E是初中化学中常见的不同类别的物质,已知A是单质;C是红棕色固体;E是水溶液可使酚酞试液变为红色的盐,图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质可制得另一物质(部分反应物、生成物及反应条件已略去),回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com