
����Ŀ���Ķ�����Ŀ��ղ��ϡ�
���������ķ�չ�����У�����������Ҫ�����á�����ǧ��ǰʹ�õ���ͭ������ǧ��ǰ��������ʱ����ֱ��20�������Ͻ��Ϊ���������Ľ������ϣ��������϶��ڴٽ�������չ����������������˾�����á�
�������ϰ��������������ǵĺϽ𡣺Ͻ���������������������ʡ���ѧ���е���ܣ�������治ͬ�ڸ��ɷֽ��������磺�Ͻ��Ӳ�ȿ��Դ������Ĵ������ɷ֣��۵�Ҳ���Ե������ijɷֽ��������ң�ʹ�ò�ͬ��ԭ�ϣ���ԭ�ϵ���Ȳ�ͬ���Ϳ��Եõ����в�ͬ���ܵĺϽ�
��ͭ���ҹ�ʹ������ĺϽ𡣶���ͭ��������34.5���ף�����45���ף���13���ף���7.15ǧ�ˡ�����ý���������߷��ˡ�����������ҹ���Բ��õĹŴ��Ƽ�������ͭ�⣬�����Ļ��л�ͭ(��п������������Ǧ������)�Ͱ�ͭ(������п����������)�ȺϽ�
�����������⣬�������������Ȼ���ж����Ի��������ʽ���ڡ�Ϊ���ܹ��ṩ��������Ľ������ϣ�����Ҫ�������ӿ�ʯ��ұ���������ҹ��Ŵ��ͷ�����ʪ����ͭ�ķ���������������ͭ������ͭ��Һ���û��������ҹ�������ʹ�ø÷����Ĺ��ҡ�
���ſƼ�ˮƽ��ұ�����յIJ�����ߣ�Ŀǰ��������ұ��������Ҫ�����¼��֣�
ұ������ | ��Ӧ��ʾʽ(������������ȥ) | �����Խ��� |
�Ȼ�ԭ�� | ����A��������+̼(��һ����̼��) | п��ͭ |
��ⷨ | ����B�Ļ����� | þ���� |
�ȷֽⷨ | ����C�������� | ������ |
��ҵ�Ͼ�������һ����̼���г�����ұ���õ���������
��������Ӧ�ù㷺���ѺϽ���һ�����ܷdz���Խ�Ľ��������Ļ�ѧ�����ȶ�����ʴ�������ǵֿ���ˮ��ʴ������ǿ��Ŀǰ�㷺���ڷɻ���������������������Ǻ�����ɴ�������
����ÿ��Ҫ����Ȼ����ȡ�����ڶּƵĽ�����ͬʱ�������Ľ���ȴ��ʴ�����ϡ�ÿ����ʴ�����ϵĽ����豸�Ͳ����൱���������20%��40%����ֹ�����ĸ�ʴ�ѳ�Ϊ��ѧ�о��ͼ��������е��ش����⡣�ش��������⣺

(1)�������������ߣ������˽�����___�ԡ�
(2)������ʯ����___(�����������������������)
(3)���ݲ��ϣ�д����ҵ���Ȼ�þұ��þ�Ļ�ѧ����ʽ___��
(4)Ϊ�˷�ֹ������ʴ�������ڽ������渽�ű���Ĥ����ԭ����___��
(5)���з��������ܼ����ͭ�ʹ�ͭ����___��
A �̻��� B AgNO3��Һ C HCl D NaNO3��Һ
(6)�ֽ�һ������Zn��Fe Ͷ�뵽����Cu(NO3)2��AgNO3�Ļ����Һ�У���ַ�Ӧ���˵õ���������Һ���������м���ϡ���ᣬ��������������Һ�п����е�������(д��ѧʽ)___��
���𰸡����� ����� MgCl2![]() Mg+Cl2�� ����������ˮ BD Cu(NO3)2��AgNO3
Mg+Cl2�� ����������ˮ BD Cu(NO3)2��AgNO3
��������
��1���������������ߣ������˽����ĵ����ԣ�
��2��������ʯ����Ҫ�ɷ������������������������ʣ����ڻ���
��3����ͨ��������£�MgCl2�����ֽⷴӦ����þ����������Ӧ�Ļ�ѧ����ʽΪ��MgCl2![]() Mg+Cl2����
Mg+Cl2����
��4��Ϊ�˷�ֹ������ʴ�������ڽ������渽�ű���Ĥ����ԭ���Ǹ���������ˮ��
��5��A��ͭ��Ӳ�ȴ���ͭ��Ӳ�ȣ����Կ��ÿ̻�������A��ȷ��
B ͭ��п������������������Ӧ�������𣬹�B����
C п�������ᷴӦ������������ͭ���ܣ����Լ��𣬹�C��ȷ��
D ͭ��п����������������Һ��Ӧ�������𣬹�D����ѡBD��
��6���ڽ����˳���У�п�������ã�����ͭ���ã�ͭ�������ã���һ������Zn��Fe Ͷ�뵽����Cu(NO3)2��AgNO3�Ļ����Һ�У�п�Ⱥ�������������ͭ��Ӧ�����ٺ�������������ͭ��Ӧ����ַ�Ӧ���˵õ���������Һ���������м���ϡ���ᣬ����������˵������п��ʣ�࣬���ֽ����У�������ã�����пһ��������������Ӧ������������ͭ����һ�������˷�Ӧ����Һ��һ�����������Σ����ܺ�������ͭ������������ѧʽ�ֱ�Ϊ��Cu(NO3)2��AgNO3��


 ���ɶ��ȫ���ƿؾ�ϵ�д�
���ɶ��ȫ���ƿؾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ᣨC2H4O3���dz������������������йع��������˵����ȷ����
A. ���������к���O3����B. ����������̼Ԫ�ص���������Ϊ31.6%
C. �����������Է�������Ϊ76gD. ����������̼���⡢��Ԫ��������Ϊ2:4:3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��G�����ֳ��г����Ļ�ѧ���ʣ����� A��B��C��D��E�ֱ������ֲ�ͬ��𣨼����ʡ�������ᡢ��Σ������ʣ�D��F��������ͬ��Ԫ����ɣ�E�ķ�ĩΪ��ɫ�����С�������ʾһ�����ʿ���ͨ��һ����Ӧת��Ϊ��һ�����ʣ����ַ�Ӧ��������Ӧ������ʡ�ԣ�����д����
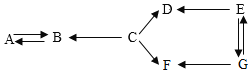
��1��F�Ļ�ѧʽ_____��
��2��B��A��Ӧ�Ļ�ѧ����ʽΪ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊʵ�ַ�������Դ�������õ�Ŀ�ģ��Ե�ʯ��[��Ҫ�ɷ�ΪCa(OH)2��CaCO3������Ca(OH)2Ϊ����]Ϊԭ���Ʊ�KClO3������Ҫ������ͼ��ʾ��

(1)�Ȼ������У�Cl2��Ca(OH)2���ã�������һϵ�б仯����������Ca(ClO3)2��CaCl2���÷�Ӧ�Ļ�ѧ����ʽ��������������Ļ�ѧ��������Ϊ1��5
������Ca(CIO3)2�Ļ�ѧ����ʽ______��
�����Cl2ת��ΪCa(ClO2)2��ת���ʵĿ��д�ʩ��______(����)��
A �ʵ�����ͨ��Cl2���� B ��ֽ��转�� C ��ˮʹCa(OH)2��ȫ�ܽ�
(2)����̿��������______������IJ�������Ϊ______������A��һ������______��
(3)����I�õ�����Һ�м����Թ���KCl����ɽ�Ca(ClO2)2ת��ΪKClO3���÷�Ӧ�Ļ�����Ӧ����Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ƽ��ʳ��Ϊ��Ҫԭ����ȡ����ƵõĴ����г����������Ȼ��ơ�Na2CO3��NaCl���ܽ��������ͼ��ʾ���Իش���������
����t1��ʱ��Na2CO3���ܽ����_____g��
��t2��ʱ��NaCl���ܽ��_____Na2CO3���ܽ��(��������������������С����֮һ)��
��Ҫ�Ӻ�ˮ����ȡNaC1��Ӧ���õķ�����_____(���������ᾧ���������½ᾧ��)��
��Ҫ��Na2CO3�IJ�������Һת��Ϊ������Һ��Ӧ���õķ�����_____(��һ�ּ���)��
��t1Cʱ������10gNa2CO3����50gˮ�У�����ܽ�õ���Na2CO3��Һ��������_____g

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���û�ѧ������ա�
(1)3���ԭ��___��
(2)����������___��
(3)4�������������___��
(4)��Ԫ��___��
(5)���SO3����Ԫ�صĻ��ϼ�___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ܱ��������мס��ҡ��������������ʣ���һ�������·�����ѧ��Ӧ��һ��ʱ���÷�Ӧǰ��������������±�������˵����ȷ���ǣ�������
���� | �� | �� | �� | �� |
��Ӧǰ���ʵ�����/g | 4 | 16 | 6 | 2 |
��Ӧ�����ʵ�����/g | 8 | 1 | x | 12 |
A. ��Ӧ�����������غ㶨��
B. ��Ϊ��Ӧ���Ϊ������������Ǹ÷�Ӧ�Ĵ���
C. �μӷ�Ӧ���ҺͶ���������Ϊ2��3
D. ��֪�Ͷ��Ļ�ѧʽ��֮��Ϊ2��5����ʽ�м��붡�Ļ�ѧ������֮��Ϊ1��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ�ش����⡣
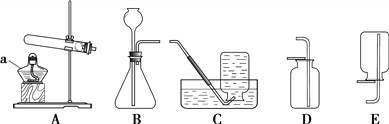
(1)����a��������_____________��
(2)�ø��������ȡ�����Ļ�ѧ����ʽΪ______________________________����Cװ���ռ�������Ӧ���е�������______________________��
(3)�ô���ʯ��ϡ������ȡ������̼ʱ����ѡ�õķ���װ����___________����Dװ���ռ�������̼������������_____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ͼ��A��Ϊ���ˮ����������ʱ���ϵͼ��ͼ��B���ǵ��ˮ�ļ���װ�ã��Իش��������⣺
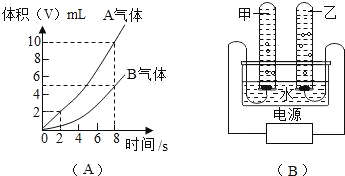
��1��д���˷�Ӧ�ı���ʽ_____��
��2�������Թ���������A�����Ӧ���ӵ�Դ��_____���������������������B��_____�����飮
��3��0s��2s�ڼ������Թ���������������8sʱ�������Թ�������������_____�����ͬ����ͬ��������һ���������ԭ�������_____��
��4����ˮͨ��ֽ�ı仯�У������ı�������ǣ�д�����ƣ�_____��û�иı��������_____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com