
����Ŀ��һ�ܱ��������мס��ҡ��������������ʣ���һ�������·�����ѧ��Ӧ��һ��ʱ���÷�Ӧǰ��������������±�������˵����ȷ���ǣ�������
���� | �� | �� | �� | �� |
��Ӧǰ���ʵ�����/g | 4 | 16 | 6 | 2 |
��Ӧ�����ʵ�����/g | 8 | 1 | x | 12 |
A. ��Ӧ�����������غ㶨��
B. ��Ϊ��Ӧ���Ϊ������������Ǹ÷�Ӧ�Ĵ���
C. �μӷ�Ӧ���ҺͶ���������Ϊ2��3
D. ��֪�Ͷ��Ļ�ѧʽ��֮��Ϊ2��5����ʽ�м��붡�Ļ�ѧ������֮��Ϊ1��1

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Cu-Zn�Ͻ���Ʒ20g��������ϡ�����У������������������뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ���Լ��㣺
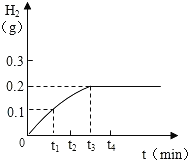
��1����Ӧ��������������Ϊ______g
��2��ԭ��Ʒ������п����������_____��
��3��ʵ����20g����Ʒ��154.7gijϡ����ǡ����ȫ��Ӧ�����ʱ�������ʵ�����_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݸ��( C3H8NO5P)��ȫ��ʹ����㷺�ij��ݼ�֮һ���������ԡ�����˵����ȷ����(����)
A. �ݸ����18��ԭ�ӹ���B. �⡢��Ԫ�ص�������Ϊ8��5
C. �ݸ����Һ�ɳ�������������������D. ����������Ԫ�ص������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ķ�����Ŀ��ղ��ϡ�
���������ķ�չ�����У�����������Ҫ�����á�����ǧ��ǰʹ�õ���ͭ������ǧ��ǰ��������ʱ����ֱ��20�������Ͻ��Ϊ���������Ľ������ϣ��������϶��ڴٽ�������չ����������������˾�����á�
�������ϰ��������������ǵĺϽ𡣺Ͻ���������������������ʡ���ѧ���е���ܣ�������治ͬ�ڸ��ɷֽ��������磺�Ͻ��Ӳ�ȿ��Դ������Ĵ������ɷ֣��۵�Ҳ���Ե������ijɷֽ��������ң�ʹ�ò�ͬ��ԭ�ϣ���ԭ�ϵ���Ȳ�ͬ���Ϳ��Եõ����в�ͬ���ܵĺϽ�
��ͭ���ҹ�ʹ������ĺϽ𡣶���ͭ��������34.5���ף�����45���ף���13���ף���7.15ǧ�ˡ�����ý���������߷��ˡ�����������ҹ���Բ��õĹŴ��Ƽ�������ͭ�⣬�����Ļ��л�ͭ(��п������������Ǧ������)�Ͱ�ͭ(������п����������)�ȺϽ�
�����������⣬�������������Ȼ���ж����Ի��������ʽ���ڡ�Ϊ���ܹ��ṩ��������Ľ������ϣ�����Ҫ�������ӿ�ʯ��ұ���������ҹ��Ŵ��ͷ�����ʪ����ͭ�ķ���������������ͭ������ͭ��Һ���û��������ҹ�������ʹ�ø÷����Ĺ��ҡ�
���ſƼ�ˮƽ��ұ�����յIJ�����ߣ�Ŀǰ��������ұ��������Ҫ�����¼��֣�
ұ������ | ��Ӧ��ʾʽ(������������ȥ) | �����Խ��� |
�Ȼ�ԭ�� | ����A��������+̼(��һ����̼��) | п��ͭ |
��ⷨ | ����B�Ļ����� | þ���� |
�ȷֽⷨ | ����C�������� | ������ |
��ҵ�Ͼ�������һ����̼���г�����ұ���õ���������
��������Ӧ�ù㷺���ѺϽ���һ�����ܷdz���Խ�Ľ��������Ļ�ѧ�����ȶ�����ʴ�������ǵֿ���ˮ��ʴ������ǿ��Ŀǰ�㷺���ڷɻ���������������������Ǻ�����ɴ�������
����ÿ��Ҫ����Ȼ����ȡ�����ڶּƵĽ�����ͬʱ�������Ľ���ȴ��ʴ�����ϡ�ÿ����ʴ�����ϵĽ����豸�Ͳ����൱���������20%��40%����ֹ�����ĸ�ʴ�ѳ�Ϊ��ѧ�о��ͼ��������е��ش����⡣�ش��������⣺

(1)�������������ߣ������˽�����___�ԡ�
(2)������ʯ����___(�����������������������)
(3)���ݲ��ϣ�д����ҵ���Ȼ�þұ��þ�Ļ�ѧ����ʽ___��
(4)Ϊ�˷�ֹ������ʴ�������ڽ������渽�ű���Ĥ����ԭ����___��
(5)���з��������ܼ����ͭ�ʹ�ͭ����___��
A �̻��� B AgNO3��Һ C HCl D NaNO3��Һ
(6)�ֽ�һ������Zn��Fe Ͷ�뵽����Cu(NO3)2��AgNO3�Ļ����Һ�У���ַ�Ӧ���˵õ���������Һ���������м���ϡ���ᣬ��������������Һ�п����е�������(д��ѧʽ)___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ���������CuSO4��Na2CO3��Na2SO4��BaCl2��NaCl�е�һ�ֻ�����ɣ�Ϊ��̽���ð�ɫ����ijɷ֣�ijͬѧ���̽����̽��������ͼ��
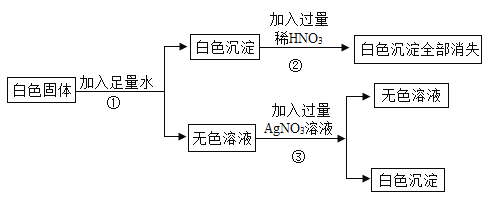
(1)�ð�ɫ������һ��û��___��������___��
(2)��Ӧ�ٵĻ�ѧ����ʽΪ___��
(3)��Ӧ�ڵĻ�ѧ����ʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������ˮ�к�̼���ƣ�������ˮ�������ˮ����Ⱦ����ѧ��ȤС����Ʒ�ˮ���������õķ���������������ʵ�飺ȡ���˺��ˮ��200g����μ���ϡ������ǡ�ò��ٲ�������Ϊֹ����Ӧ��������������������ϡ�����������ϵ��ͼ��ʾ����ش��������⣨̼���������ᷴӦ�Ļ�ѧ����ʽΪ��Na2CO3+2HCl��2NaCl+H2O+CO2����������ˮ�������ʵ�Ӱ�죩��
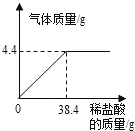
��1����Ӧ����CO2�����������_____g��
��2�����ˮ��̼���Ƶ�����������____��д��������̣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС���θҩ��̼������Ƭ��������̽���������������£�
��ȡ1Ƭθҩ���飬��ˮ��ȫ�ܽ�õ�100g��Һ��
������100g 0.365%��ϡ������Ϊģ��θ�
��ȡ����һ����Һ20g����ƿ�У��ٽ���һ����Һ��μ�����ƿ�ڣ���Ӧ����Һ��pH�仯�����ͼ��ʾ��
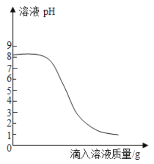
��ش��������⣺
��1��̼����������______����ᡱ������Ρ�����
��2��������У���������һ����Һ������Ϊ10gʱ����ƿ������ǡ����ȫ��Ӧ��θҩ�������ɷֲ��μӷ�Ӧ���������ʵ�����ݼ���ÿƬθҩ��̼�����Ƶ�������д����Ҫ�ļ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���û�����ʯ����Ҫ�ɷ�FeS2�������������������ڷ���¯�б��գ�����һϵ�еķ�Ӧ�õ����ᣮ���պ�Ŀ�����������������ת��������ͼ��
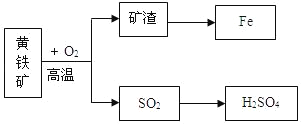
��ش���������
��1����ȫ����FeS2�Ļ�ѧ����ʽ��4FeS2+11O2![]() 2_____+8SO2����
2_____+8SO2����
��2���ÿ��������Ļ�ѧ����ʽ_____��
��3��д����Ȼ����ij��������γ����꣨SO2��H2SO4����һ��;���ķ�Ӧԭ��_____��
��4���������������ķ�����_____��
��5��������ת����������Ԫ�س��ֵĻ��ϼ���_____��
��6��úȼ�չ�����Ҳ�������������Ϊ��ֹ������Ⱦ����ҵ�ϱ���������������䷴Ӧԭ���У�2CaCO3+2SO2+O2�T2CaSO4+2CO2����Ҫ����32kg�Ķ����������壬��������Ҫ̼��Ƶ�����Ϊ_____��
��7���û�����ʯ������Σ����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ִ������г�����һ�ֽ�ͨ���ߡ�
����������ӻ�����������ǵ���ʴ������ԭ����___��
����Ȼ��(��Ҫ�ɷ��Ǽ���)��������������ȼ�ϣ�����ȫȼ�յĻ�ѧ����ʽ��___����Ȼ����Һ��ʯ����(��Ҫ�ɷ��DZ���Ͷ���)��̼Ԫ�ص����������ֱ�ԼΪ75%��82.3%��ͨ�������ݷ�������ͬ�����£�����Ȼ����ȼ��(���ȼ��)��Һ��ʯ����������������___��
��Ŀǰ����β������ô�ת���ķ�������������д���ڴ��������µ���������(��NO��ʾ)��CO��Ӧ���ɶ�����̼�͵����Ļ�ѧ����ʽ��___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com