
【题目】反应物的质量比不同可能会影响生成物的种类,为探究碳还原氧化铜生成的气体种类,设计了下列实验(所有反应均充分进行,浓硫酸用以吸收水蒸汽):
(提出问题):碳还原氧化铜生成的气体是什么?
(作出猜想):猜想①:CO 猜想②:CO2 猜想③:CO2和CO
(实验设计):装置图如图
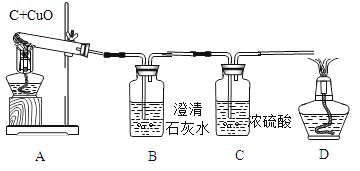
方案一:从定性观察角度判断:
①实验时,A中出现_________________的现象。
②若猜想①成立,B、D处的实验现象是:
B________________,D_________________。
方案二:从定量计算角度判断:
测定表格中的四个数据:
反应前的质量 | 反应后的质量 | |
A(试管+固体) | m1 | m2 |
B+C(广口瓶+溶液) | m3 | m4 |
③若猜想②成立,则(m4-m3)_____(m1-m2)(选填“>”、“<”、“=”)。此时A中发生反应的化学方程式为_____________________________。
④若猜想③成立,且8gCuO全部参与反应,则碳的物质的量(n)的取值范围是____<n<_____。
【答案】黑色固体逐渐变红 产生气泡 气体燃烧,产生淡蓝色火焰 = 2CuO+C![]() 2Cu+CO2↑ 0.05mol 0.1mol
2Cu+CO2↑ 0.05mol 0.1mol
【解析】
①实验时A处高温条件下,氧化铜和碳反应生成铜和碳的氧化物,实验现象是黑色固体逐渐变红。
故填:黑色固体逐渐变红。
②若猜想①成立,一氧化碳不溶于澄清石灰水,B产生气泡,D处一氧化碳燃烧生成二氧化碳,发出蓝色火焰。
故填:产生气泡;气体燃烧,产生蓝色火焰。
③若猜想②成立,m4-m3和m1-m2都是反应生成的二氧化碳质量,因此(m4-m3)=(m1-m2);
此时A中氧化铜和碳反应生成铜和二氧化碳,发生反应的化学方程式是:2CuO+C![]() 2Cu+CO2↑。
2Cu+CO2↑。
故填:=;2CuO+C![]() 2Cu+CO2↑。
2Cu+CO2↑。
④设8g氧化铜和碳反应全部生成铜和二氧化碳时碳的物质的量为x,8g氧化铜和碳反应全部生成铜和一氧化碳时碳的物质的量为y,
8g氧化铜的物质的量为:8g÷80g/mol=0.1mol,
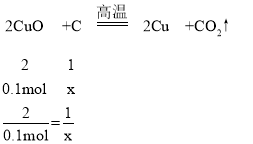
x=0.05mol,
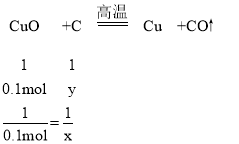
y=0.1mol,
若猜想③成立,且8gCuO全部参与反应,则碳的物质的量(n)的取值范围是0.05mol<n<0.1mol。
故填:0.05mol<n<0.1mol。


科目:初中化学 来源: 题型:
【题目】如图是甲、乙、丙三种固体物质的溶解度曲线,据图回答下列问题。
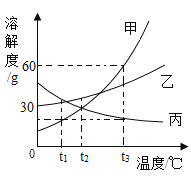
(1)0℃时,乙物质的溶解度是___________。
(2)t1℃时,三种物质溶解度由大到小的顺序是___________。
(3)t3℃时,将70g甲物质加到100g水中,充分搅拌后所得溶液的质量是______g。
(4)t3℃时,将甲、乙、丙三物质的饱和溶液同时降温至t2℃,它们溶质的质量分数由大到小的顺序是_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】NaCl 和KNO3在不同温度时的溶解度如下,回答下列问题。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
(1)10℃时,在100 g水里溶解_________g KNO3时,溶液恰好达到饱和状态。
(2)右图为NaCl 和KNO3的溶解度曲线,则表示NaCl的溶解度曲线是_________(填“甲”或“乙”);其中温度t的范围可能在________(填字母序号)。
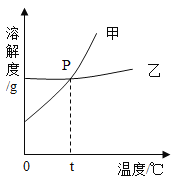
A.10℃~20℃ B.20℃~30℃
C.30℃~40℃ D.40℃~50℃
(3)10℃时,分别在100 g水中加入35 g NaCl 和KNO3固体,加热到60℃时,NaCl溶液为__________(填“饱和”或“不饱和”)溶液。加热前后,有关两溶液的说法正确的是____________(填字母序号)。
A.10℃时,两溶液中溶质的质量分数相同
B.60℃时,两溶液中溶质的质量分数相同
C.加热前后,NaCl溶液中溶质的质量分数不变
D.加热前后,KNO3溶液中溶质的质量分数不变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】图1表示向20℃时100g水中加入20g硝酸钾进行的系列实验,①—⑤表示实验所得溶液;图2是NaCl、KNO3的溶解度曲线。
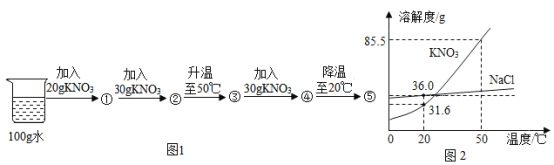
①0℃时溶解度较大的物质是___,20℃时硝酸钾的溶解度是___g/100g水,③是____(填“饱和”或“不饱和”)溶液,其溶质的质量分数为_____(列式即可)。
②50℃时,将接近饱和的硝酸钾溶液变为饱和溶液的方法是______(写一种即可)。
③50℃时,饱和NaCl溶液中溶质的质量分数(w1)与饱和KNO3溶液中溶质的质量分数(w2)的大小关系是:w1___w2(选填“>”“=”或“<”)。
④已知②→③的过程中有少量水蒸发,下列叙述正确的是____(填序号)。
a.①、②均为不饱和溶液 b.②→③的过程中溶质质量分数变大 c.④→⑤的过程中析出KNO3晶体53.9g
⑤除去KNO3固体中混有的少量NaCl的实验操作为:加适量水溶解→加热得到热饱和溶液→____→过滤→洗涤→干燥→KNO3。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下面科普短文![]() 改编自屠呦呦2015年12月7日瑞典演讲稿
改编自屠呦呦2015年12月7日瑞典演讲稿![]() 。
。
很多中药古方都提到了青蒿入药抗疟疾,但当1971年开始从青蒿中提取有效成分时,结果却总是不理想,屠呦呦研究组反复研究中医古籍,其中“青蒿一握,以水两升渍,绞取汁,尽服之“激发了她的灵感,是不是高温下破坏了青蒿中抗疟的有效成分?屠呦呦立即改用乙醚在较低温度下进行提取,成功获得了抗疟有效单体的提纯物质,命名为青蒿素。
完成样品纯化后,通过元素分析、光谱测定、质谱及旋光分析等技术手段,测定相对分子质量为282,得出了青蒿素的化学式。但青蒿素的具体结构是什么样的呢?有机所得专家做了一个定性实验,加入碘化钾后,青蒿素溶液变黄了,说明青蒿素中含有过氧基团;而后专家又通过X射线衍射法等方法,最终确定了青蒿素是含有过氧基的新型倍半萜内酯。
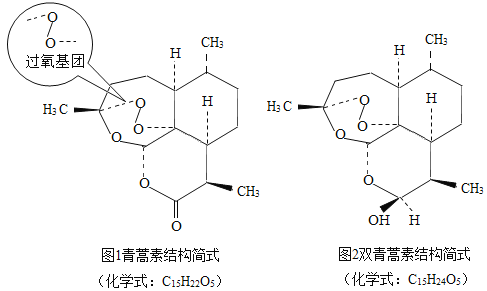
由于自然界中天然青蒿素的资源是有限的,接下来就要把自然界的分子通过人工合成制成药物,在这一过程中,研究组又有一项重大研究成果,获得了青蒿素的衍生物,衍生物之一是双氢青蒿素,它也具有抗疟的疗效,并且更加稳定,水溶性好,比青蒿素的疗效好,10倍,进一步体现了青蒿素类药物“高效、速效、低毒”的特点。
依据文章内容,回答下列问题:
(1)从中国古代青蒿入药,到2004年青蒿素类药物被世界卫生组织列为对抗疟疾的首选药物,经历了漫长的历程。将下列三项针对青蒿素的研究按时间先后排序______(填数字序号)。
①确定结构 ②分离提纯 ③人工合成
(2)屠呦呦用乙醚提取青蒿素,获得成功的关键在于改变了哪种条件:______。
(3)向无色的双氢青蒿素溶液中加入碘化钾,实验现象为______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】生活离不开水,我们可以从组成、结构等多角度认识水。
(1)下图所示实验中,试管a,b中产生气体的体积比约为____________,a气体的化学式是_____________,该实验证明水是由_____________组成的。
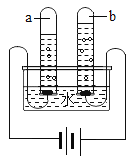
(2)每个水分子是由___________构成的。
(3)有氢气、氧气混合气体20g,经充分反应后得到18g水,则原混合气体中含氧气质量可能是_____________________(填字母)
A16g B8g C18g D4g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现在很多家庭都使用太阳能热水器。太阳能热水器节能环保,深受消费者喜爱。如图所示的是某太阳能热水器的构造。请回答下列问题。

(1)图中所标示的物质中属于合金材料的是________(填序号)。
(2)太阳能热水器的支架使用的是铝合金材料,而没有使用铁制材料,原因是_________。
(3)普通玻璃的主要成分之一是硅酸钠(![]() ),标出硅酸钠中硅元素的化合价_______。
),标出硅酸钠中硅元素的化合价_______。
(4)设计一个实验,比较铝、铁的金属活动性强弱__________(用化学方程式表示)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】随着社会生活节奏的加快,方便面越来越受人们的喜爱,如图是某品牌方便面标签的部分内容,资料显示,淀粉可水解为葡萄面:其方程式为: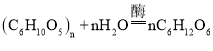 .
.

请计算:(1)淀粉中碳、氧、氢原子个数比________________。
(2)据标签。若面饼中淀粉含量为90%,则该面饼可水解成多少克葡萄糖_________?(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com