
【题目】硒元素有防癌抗癌作用,硒原子的结构示意图及硒元素在周期表中的信息如下图所示,下列说法不正确的是
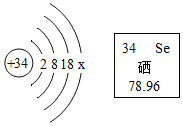
A.x 的数值是6
B.硒元素属于金属元素
C.硒原子中质子数为34
D.硒元素属于人体必需的微量元素
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
【题目】Na2CO3在工业和生活中有重要的作用。它的来源主要有以下两种途径:
I.将制碱与制氨结合起来的联合制碱法。这个方法是由我国的制碱工业先驱_发明的。
A 张青莲
B 道尔顿
C 侯德榜
D 华罗庚
Ⅱ.自然界有很多咸水湖,人们通过“冬天捞喊,夏天晒盐”的方式获得湖盐,其中就含有Na2CO3。
(1)小明同学想对某夏天制得的湖盐样品成分进行探究,查阅资料后他对样品成分做出了三种猜想。
猜想一:NaCl、Na2CO3
猜想二:NaCl、Na2SO4;
猜想三:NaCl、Na2CO3、Na2SO4请帮助他完成如下实验:
实验操作 | 实验现象 | 实验结论 | |
实验一 | 取少量样品于试管中,加适量水溶解后,加入过量稀HNO3 | 产生能使澄清石灰水变浑浊的气体 | 猜想___不成立 |
实验二 | 向实验一所得的溶液中加入适量的________ | __ | 猜想三成立 |
(2)小明同学为进一步确定上述湖盐样品中Na2CO3 的质量分数,取该湖盐样品10.0g做了如图所示的补充实验。(注:所用药品均足量)
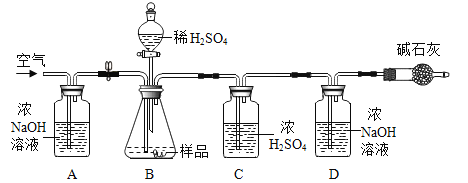
①反应结束之后打开止水夹并通入空气的目的是____。
②装置D中发生的反应为____(用化学方程式表示)。
③实验中碱石灰(含氧化钙和氢氧化钠)的作用是___。
④实验结束后,测得装置D增重0.33g,则该湖盐样品中Na2CO3的质量分数为多少___?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】回答下列问题。
(1)“侯氏制碱法”制备Na2CO3的流程如下。
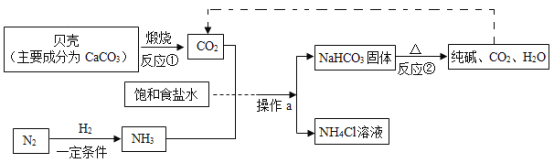
①反应②的化学方程式是___。
②操作a的名称是__,实验室进行此操作所需的主要玻璃仪器有烧杯、玻璃棒和____。
③流程图中能循环利用的物质是_(填化学式) ,副产品为_ ( 填化学式)。
(2)实验室制备纯碱( Na2CO3 )的主要步骤为:将饱和NaCl溶液倒入烧杯加热,控制30~35°C,搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质、抽干,转入蒸发皿中灼烧得Na2CO3固体。
四种盐在不同温度下的溶解度表( g/100g水)
温度 溶解度 | 0°C | 10° C | 20° C | 30° C | 40° C | 50° C | 60°C | 100°C |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | 一 | 一 | 一 | 一 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 16.4 | 一 | |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
①反应温度需要控制在30~ 35°C ,原因是__。为控制此温度,通常采取的加热方法为___。
②保温30分钟,静置后只析出NaHCO3晶体的原因__。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】建立宏观与微观之间的联系,是化学学科特有的思维方式。
(1)图中A、B、C、D是四种粒子的结构示意图,E是碘元素在元素周期表中的信息。回答下列问题:
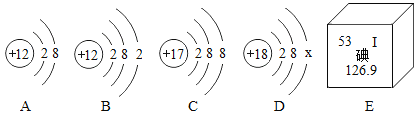
①A、B、C、D四种粒子共表示_______________种元素。
②构成氯化镁的微粒是________________(填字母序号)。
③E中碘元素原子的核内质子数为______________________。
(2)如图是某化学反应微观示意图。在点燃条件下,A和B反应生成C和D。
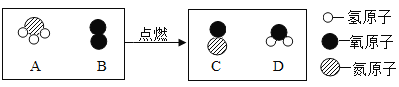
①1个A分子中含有__________个原子。
②A中氮元素和氢元素的质量比为____________________。
③A在B中充分燃烧的化学方程式为____________________。
④生成C与D的质量比是____________________。
(3)请你根据表中信息,类推出丙酸的化学式____________________。
物质名称 | 甲酸 | 乙酸 | 丙酸 | 丁酸 | 戊酸 |
化学式 | CH2O2 | C2H4O2 | ? | C4H8O2 | C5H10O2 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图为实验室制取氢气的发生装置.若液面刚好不与锌粒接触而又无酸液可加,要得到氢气, 可从长颈漏斗中加入的适量试剂是( )
①食盐水;②硫酸钠溶液;③氯化钡溶液;④碳酸钠溶液
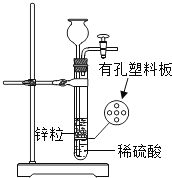
A.①②③B.①②④C.②③④D.①③④
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)用途广泛,实验室以CuSO4为原料制备Cu2O步骤如下:
预热:分别预热CuSO4溶液和Na2SO3溶液。
反应:在玻璃反应器中混合上述两种溶液,热水浴,搅拌,同时控制反应液pH。
处理:自然冷却后过滤,用蒸馏水洗涤4~5次,在80℃真空干燥箱中烘干,保存产品。
已知:Cu2O在潮湿空气中会逐渐氧化成CuO。
(1)反应原理为2CuSO4+3Na2SO3![]() Cu2O↓+3_+2SO2↑。实验时,热水浴加热的优点是___。
Cu2O↓+3_+2SO2↑。实验时,热水浴加热的优点是___。
(2)实验中,反应温度、反应液pH对产物中Cu2O%的影响分别如图所示:
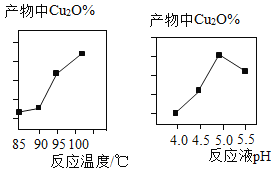
分析图像可知:最佳反应温度为____℃,该反应温度的优点有①____、②____。最佳反应液pH为_,若pH过低,产物中会有Cu杂质,则产物中Cu元素的质量分数将__(填“偏大”或“偏小”或“不变”)。
(3)产品洗净的标准是:取最后一次洗涤液,加入____(填试剂名称)溶液,若无白色沉淀产生,则说明已经洗净。
(4)产品烘干及保存要避免和潮湿空气接触,原因是____(填化学方程式)。
(5)工业上用CuSO4·5H2O制备Cu2O,若得到14.40吨Cu2O和一定质量的CuO(假设生产过程中Cu元素无损失),其中Cu2O和CuO的质量比为12:1,计算需要CuSO4·5H2O多少吨?写出计算过程,精确到小数点后两位)____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学为了探究相关金属的化学性质,做了下列实验:

(1)A试管中实验现象是_____。
(2)只通过A和B实验尚不能证明铜、银两种金属的活动性强弱,需补充一个实验来证明,补充实验所用试剂不合理的是_____。
A Cu、Ag、稀盐酸 B Cu、AgNO3溶液 C Cu(NO3)2溶液、Ag
(3)实验C中物质充分反应后,某同学对试管中固体的成分提出以下四种猜想:
A Zn、Cu、Ag B Zn、Cu C Cu、Ag D Ag
这四种猜想中你认为有可能的是_____(填编号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙两种不含结晶水的固体物质的溶解度曲线,下列有关说法正确的是( )
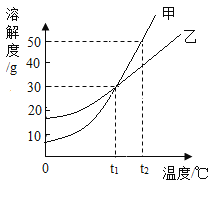
A.在t1℃时甲、乙两种物质的饱和溶液中所含的溶质质量相等
B.t1℃时,甲、乙两种物质的溶质质量分数相等
C.甲、乙两种物质的溶解度都随着温度的升高而增大
D.将甲、乙两种物质的饱和溶液从t1℃升温到t2℃,所得到的溶液中甲的溶质质量分数大于乙的溶质质量分数
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学用如图总结NaOH的四类化学性质(即NaOH能够与四类物质发生化学反应)。
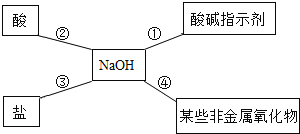
(1)为验证性质①,该同学将无色酚酞试液滴入NaOH溶液中,溶液颜色由无色变成______;
(2)性质②的反应为中和反应,试写出NaOH与盐酸反应的化学方程式______;
(3)为了验证性质③,该同学可选择的物质是______(填序号)。
A Na2CO3 B CO2 C FeCl2 D Ba(NO3)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com