
【题目】氧化亚铜(Cu2O)用途广泛,实验室以CuSO4为原料制备Cu2O步骤如下:
预热:分别预热CuSO4溶液和Na2SO3溶液。
反应:在玻璃反应器中混合上述两种溶液,热水浴,搅拌,同时控制反应液pH。
处理:自然冷却后过滤,用蒸馏水洗涤4~5次,在80℃真空干燥箱中烘干,保存产品。
已知:Cu2O在潮湿空气中会逐渐氧化成CuO。
(1)反应原理为2CuSO4+3Na2SO3![]() Cu2O↓+3_+2SO2↑。实验时,热水浴加热的优点是___。
Cu2O↓+3_+2SO2↑。实验时,热水浴加热的优点是___。
(2)实验中,反应温度、反应液pH对产物中Cu2O%的影响分别如图所示:
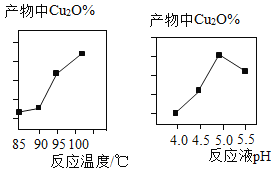
分析图像可知:最佳反应温度为____℃,该反应温度的优点有①____、②____。最佳反应液pH为_,若pH过低,产物中会有Cu杂质,则产物中Cu元素的质量分数将__(填“偏大”或“偏小”或“不变”)。
(3)产品洗净的标准是:取最后一次洗涤液,加入____(填试剂名称)溶液,若无白色沉淀产生,则说明已经洗净。
(4)产品烘干及保存要避免和潮湿空气接触,原因是____(填化学方程式)。
(5)工业上用CuSO4·5H2O制备Cu2O,若得到14.40吨Cu2O和一定质量的CuO(假设生产过程中Cu元素无损失),其中Cu2O和CuO的质量比为12:1,计算需要CuSO4·5H2O多少吨?写出计算过程,精确到小数点后两位)____
【答案】Na2SO4 受热均匀,容易控制温度 100 产物中氧化亚铜的含量最大 反应速度快 5.0 偏大 氯化钡 2Cu2O+O2=4CuO 53.75吨。
【解析】
(1)反应前铜、硫、钠、氧原子个数依次为2、5、6、17;反应后铜、硫、钠、氧原子个数依次为2、2、0、5;反应原理为2CuSO4+3Na2SO3![]() Cu2O↓+3 Na2SO4+2SO2↑。实验时,热水浴加热的优点是:受热均匀,容易控制温度。
Cu2O↓+3 Na2SO4+2SO2↑。实验时,热水浴加热的优点是:受热均匀,容易控制温度。
(2)
分析图像可知:最佳反应温度为100℃,该反应温度的优点有①产物中氧化亚铜的含量最大、②反应速度快。pH为5.0时,产物中氧化亚铜的含量最大,最佳反应液pH为5.0,若pH过低,产物中会有Cu杂质,铜是单质,只含有铜元素,则产物中Cu元素的质量分数将偏大。
(3)氯化钡和硫酸钠反应生成硫酸钡和氯化钠。产品洗净的标准是:取最后一次洗涤液,加入氯化钡溶液,若无白色沉淀产生,则说明没有硫酸钠,已经洗净。
(4)产品烘干及保存要避免和潮湿空气接触,原因是氧化亚铜和氧气反应生成氧化铜,化学方程式为2Cu2O+O2=4CuO。
(5)
设氧化铜的质量为x,
14.40吨:x=12:1,x=1.2吨,
![]() ,
,![]()
12.8吨+0.96吨=13.76吨
CuSO4·5H2O中铜元素的质量分数为![]()
13.76吨÷25.6%=53.75吨。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:初中化学 来源: 题型:
【题目】请根据下列装置图,回答有关问题:
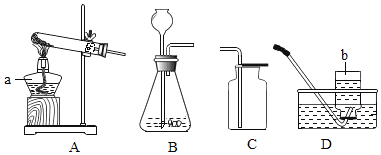
(1)写出装置图中标号仪器的名称:a_____,b_______。
(2)写出实验室用高锰酸钾制取氧气的化学方程式____,可选用的发生装置是____(填字母)。
(3)写出实验室用锌粒与稀硫酸制取氢气的化学方程式______,可选用的收集装置是_____(填字母)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学概念之间在逻辑上有如图所示的部分关系,有关下列概念之间关系的说法中正确的是()
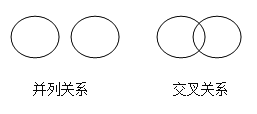
A.化合物与氧化物属于并列关系
B.氧化反应与化合反应属于交叉关系
C.纯净物与混合物属于包含关系
D.分解反应和复分解反应属于包含关系
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组欲测定铁矿石中氧化铁的含量,取一定量的矿石粉碎后,用下图方式进行实验,(注意:杂质既不溶于水也不与酸反应,实验过程中物质的损失忽略不计)
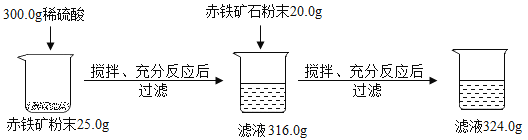
(1)求赤铁矿中氧化铁的质量分数是 。
(2)原300.0g稀硫酸中溶质的质量分数。(写出计算过程,结果保留0. 1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硒元素有防癌抗癌作用,硒原子的结构示意图及硒元素在周期表中的信息如下图所示,下列说法不正确的是
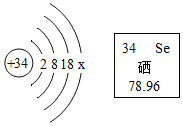
A.x 的数值是6
B.硒元素属于金属元素
C.硒原子中质子数为34
D.硒元素属于人体必需的微量元素
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】溶液与人类生产、生活密切相关,请根据要求回答相关问题。
(1)A、B、C三种固体物质的溶解度曲线如图所示。
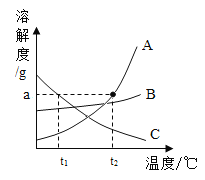
①![]() 时,A、B、C三种物质的溶解度由小到大的顺序是_____。
时,A、B、C三种物质的溶解度由小到大的顺序是_____。
②A、B、C三种物质中,溶解度随受温度影响较小的是_____。
③![]() 时,完全溶解agA物质最少需要水的质量是_____g。
时,完全溶解agA物质最少需要水的质量是_____g。
④![]() 时,A饱和溶液的溶质质量分数_____B饱和溶液溶质质量分数(填“大于”、“等于”或“小于”)
时,A饱和溶液的溶质质量分数_____B饱和溶液溶质质量分数(填“大于”、“等于”或“小于”)
(2)实验室欲除去粗盐样品中含有的不溶性泥沙,在过滤操作中需要用到的实验仪器和用品有:烧杯、铁架台(带铁圈)、漏斗、_____和滤纸。
(3)在实验室中,配制溶质质量分数为9%的氯化钠溶液100g,需要氯化钠固体的质量是_____g。将100g9%的氯化钠溶液配成含氯化钠为0.9%的溶液,需加入蒸馏水的质量至少是_____g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】图甲所示为t1℃时相同质量的A、B两种物质分别溶解在100g的水中,再将两种溶液分别升温至t2℃、t3℃时溶液的变化情况;图乙所示为两种物质的溶解度曲线。下列说法正确的是( )
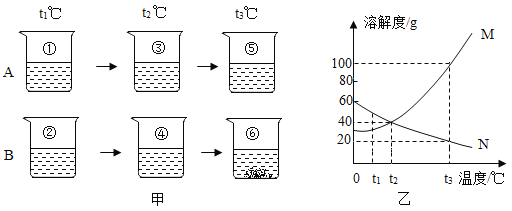
A.M表示物质B的溶解度曲线
B.t1℃时,加入物质A、B的质量均是20g
C.t2℃时,溶液④一定是饱和溶液
D.t3℃时,向溶液⑤加入60g物质A,可全部溶解
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是A、B、C三种物质的溶解度曲线,请回答:

(1)t1℃时,A、B、C三种物质的溶解度由大到小的顺序是_______。
(2)t1℃时,30 g A物质加入到50 g水中不断搅拌,形成的溶液质量是_______g。
(3)将t1℃时A、B、C三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数由大到小的顺序是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com