
【题目】化学概念之间在逻辑上有如图所示的部分关系,有关下列概念之间关系的说法中正确的是()
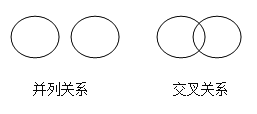
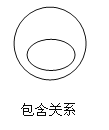
A.化合物与氧化物属于并列关系
B.氧化反应与化合反应属于交叉关系
C.纯净物与混合物属于包含关系
D.分解反应和复分解反应属于包含关系
【答案】B
【解析】
根据已有的知识进行分析,进行物质分类时,根据组成物质种类知否单一,将物质氛围混合物和纯净物,根据组成纯净物的元素种类是否单一将纯净物分为单质和化合物,含有两种元素且其中一种是氧元素的化合物称为氧化物,分解反应和复分解反应是化学反应的基本反应类型,氧化反应和化合反应是不同的分类方法。
A、含有两种元素且其中一种是氧元素的化合物称为氧化物,故化合物包含氧化物,是包含关系,故错误;
B、氧化反应和化合反应是对化学反应的不同分类方法,有些反应既是化合反应又是氧化反应,比如碳与氧气反应生成二氧化碳,故二者是交叉关系,故正确;
C、纯净物和混合物是并列关系,故错误;
D、分解反应和复分解反应是化学反应的基本反应类型,属于并列关系,故错误;
故选:B。


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
【题目】金属M与AgNO3溶液反应的化学方程式为:M+2AgNO3=M(NO3)2+2Ag。则下列说法错误的是( )
A.M的金属活动性比Ag强B.金属M可能是铝
C.该反应属于置换反应D.该反应前后M的化合价发生了改变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示,试管中盛有一段镁条,向试管中加入过量稀盐酸,观察到U形管中a处液面下降,b处液面上升。回答下列问题:
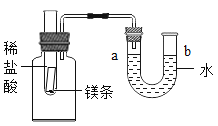
(1)镁条与稀盐酸反应的化学方程式为_____。
(2)U形管中液面发生变化的原因是_____。
(3)将试管中的物质换成水和另一种固体,可以让U型管内产生同样现象,则“另一种固体”是_____;若U型管内b处液面下降,a处液面上升,则“另一种固体”是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙、丙三种物质的溶解度曲线,下列分析错误的是
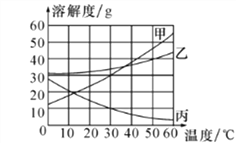
A. 30℃时,把10g丙溶解在50g水中,得到丙的饱和溶液
B. 50℃时,把甲、乙、丙三种溶液降温至10℃,析出晶体的质量由大到小的顺序为:甲>丙>乙
C. 将甲的饱和溶液变为不饱和溶液,可采用升高温度的方法
D. 30℃时,甲的饱和溶液的溶质质量分数约为23.1%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】回答下列问题。
(1)“侯氏制碱法”制备Na2CO3的流程如下。
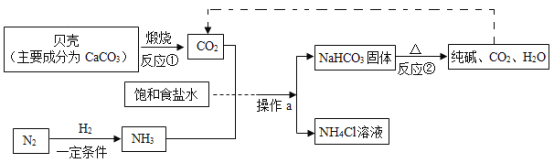
①反应②的化学方程式是___。
②操作a的名称是__,实验室进行此操作所需的主要玻璃仪器有烧杯、玻璃棒和____。
③流程图中能循环利用的物质是_(填化学式) ,副产品为_ ( 填化学式)。
(2)实验室制备纯碱( Na2CO3 )的主要步骤为:将饱和NaCl溶液倒入烧杯加热,控制30~35°C,搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质、抽干,转入蒸发皿中灼烧得Na2CO3固体。
四种盐在不同温度下的溶解度表( g/100g水)
温度 溶解度 | 0°C | 10° C | 20° C | 30° C | 40° C | 50° C | 60°C | 100°C |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | 一 | 一 | 一 | 一 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 16.4 | 一 | |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
①反应温度需要控制在30~ 35°C ,原因是__。为控制此温度,通常采取的加热方法为___。
②保温30分钟,静置后只析出NaHCO3晶体的原因__。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某研究小组为探究“铁丝和盐酸反应的快慢与什么因素有关”,取相同质量的铁丝和足量的盐酸反应得到下表中的三组实验数据,请回答下列问题:
实验编号 | 盐酸的质量分数/% | 反应温度/°C | 铁丝消失的时间/s |
① | 3 | 20 | 300 |
② | 6 | 20 | 200 |
③ | 6 | 40 | 40 |
(1)写出铁丝和盐酸反应的化学方程式:________________。
(2)实验②和③可探究________对铁丝和盐酸反应快慢的影响。若欲探究浓度对铁丝和盐酸反应快慢的影响,应选择的实验编号是____________。
(3)根据上表中的实验数据,可得出的结论是_______(写出一点即可)。
(4)如果把上表中实验②的反应温度改为25°C,请推测铁丝消失的时间t的取值范围:__________。
(5)实验除了用铁丝消失的时间来衡量反应的快慢外,你还能提出新的方法来衡量该反应的快慢吗?你的方法有________(写一点即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】建立宏观与微观之间的联系,是化学学科特有的思维方式。
(1)图中A、B、C、D是四种粒子的结构示意图,E是碘元素在元素周期表中的信息。回答下列问题:
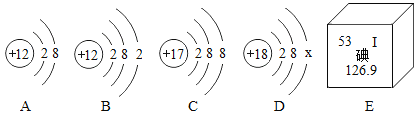
①A、B、C、D四种粒子共表示_______________种元素。
②构成氯化镁的微粒是________________(填字母序号)。
③E中碘元素原子的核内质子数为______________________。
(2)如图是某化学反应微观示意图。在点燃条件下,A和B反应生成C和D。
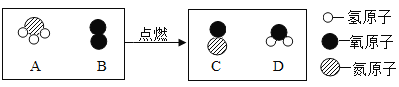
①1个A分子中含有__________个原子。
②A中氮元素和氢元素的质量比为____________________。
③A在B中充分燃烧的化学方程式为____________________。
④生成C与D的质量比是____________________。
(3)请你根据表中信息,类推出丙酸的化学式____________________。
物质名称 | 甲酸 | 乙酸 | 丙酸 | 丁酸 | 戊酸 |
化学式 | CH2O2 | C2H4O2 | ? | C4H8O2 | C5H10O2 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)用途广泛,实验室以CuSO4为原料制备Cu2O步骤如下:
预热:分别预热CuSO4溶液和Na2SO3溶液。
反应:在玻璃反应器中混合上述两种溶液,热水浴,搅拌,同时控制反应液pH。
处理:自然冷却后过滤,用蒸馏水洗涤4~5次,在80℃真空干燥箱中烘干,保存产品。
已知:Cu2O在潮湿空气中会逐渐氧化成CuO。
(1)反应原理为2CuSO4+3Na2SO3![]() Cu2O↓+3_+2SO2↑。实验时,热水浴加热的优点是___。
Cu2O↓+3_+2SO2↑。实验时,热水浴加热的优点是___。
(2)实验中,反应温度、反应液pH对产物中Cu2O%的影响分别如图所示:
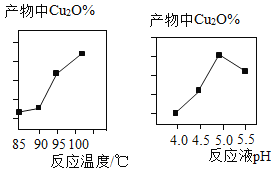
分析图像可知:最佳反应温度为____℃,该反应温度的优点有①____、②____。最佳反应液pH为_,若pH过低,产物中会有Cu杂质,则产物中Cu元素的质量分数将__(填“偏大”或“偏小”或“不变”)。
(3)产品洗净的标准是:取最后一次洗涤液,加入____(填试剂名称)溶液,若无白色沉淀产生,则说明已经洗净。
(4)产品烘干及保存要避免和潮湿空气接触,原因是____(填化学方程式)。
(5)工业上用CuSO4·5H2O制备Cu2O,若得到14.40吨Cu2O和一定质量的CuO(假设生产过程中Cu元素无损失),其中Cu2O和CuO的质量比为12:1,计算需要CuSO4·5H2O多少吨?写出计算过程,精确到小数点后两位)____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我们的生活离不开化学,学好化学能帮助我们解决很多生活中的问题:
(1)家里用的光盘、三角板等是塑料制品,丢弃时处理的方法应该是_____。(填序号下同)
A 焚烧 B 随意丢弃 C 回收利用 D 掩埋
(2)热敷袋主要用于治疗关节痛、胃寒等,热敷袋中发热剂主要是铁粉、水、活性炭和食盐。热敷袋发热蕴含的化学原理是_____。
(3)热水瓶胆壁上水垢的主要成分是碳酸钙和氢氧化镁,可用醋酸溶解除去。已知醋酸与氢氧化镁反应的化学方程式为:2CH3COOH+Mg(OH)2=(CH3COO)2Mg+2H2O,则醋酸与碳酸钙反应的化学方程式是_____。
(4)区别蚕丝、棉线最简单的方法是_____。
(5)武汉方舱医院建成用到了大量建筑材料,以下对建筑材料主要成分的分类不正确的是_____。
A 碳酸钙-盐 B 钢-单质 C 生石灰-氧化物 D 聚氯乙烯-有机物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com