
【题目】溶液与人类生产、生活密切相关,请根据要求回答相关问题。
(1)A、B、C三种固体物质的溶解度曲线如图所示。
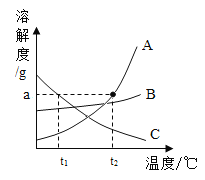
①![]() 时,A、B、C三种物质的溶解度由小到大的顺序是_____。
时,A、B、C三种物质的溶解度由小到大的顺序是_____。
②A、B、C三种物质中,溶解度随受温度影响较小的是_____。
③![]() 时,完全溶解agA物质最少需要水的质量是_____g。
时,完全溶解agA物质最少需要水的质量是_____g。
④![]() 时,A饱和溶液的溶质质量分数_____B饱和溶液溶质质量分数(填“大于”、“等于”或“小于”)
时,A饱和溶液的溶质质量分数_____B饱和溶液溶质质量分数(填“大于”、“等于”或“小于”)
(2)实验室欲除去粗盐样品中含有的不溶性泥沙,在过滤操作中需要用到的实验仪器和用品有:烧杯、铁架台(带铁圈)、漏斗、_____和滤纸。
(3)在实验室中,配制溶质质量分数为9%的氯化钠溶液100g,需要氯化钠固体的质量是_____g。将100g9%的氯化钠溶液配成含氯化钠为0.9%的溶液,需加入蒸馏水的质量至少是_____g。
【答案】C>B>A B 100 大于 玻璃棒 9 900
【解析】
(1)①![]() 时,A、B、C三种物质的溶解度由小到大的顺序是C>B>A;
时,A、B、C三种物质的溶解度由小到大的顺序是C>B>A;
②溶解度曲线越平缓,该物质溶解度受温度影响越小,故A、B、C三种物质中,溶解度受温度影响较小的是B;
③![]() 时,A物质溶解度为ag,即100g水中最多能溶解ag A物质,故完全溶解ag A物质最少需要100g水;
时,A物质溶解度为ag,即100g水中最多能溶解ag A物质,故完全溶解ag A物质最少需要100g水;
④![]() 时,A物质的溶解度大于B物质的溶解度,一定温度下饱和溶液的溶质质量分数=
时,A物质的溶解度大于B物质的溶解度,一定温度下饱和溶液的溶质质量分数=![]() ,故配成饱和溶液时,A物质饱和溶液的溶质质量分数大于B物质的;
,故配成饱和溶液时,A物质饱和溶液的溶质质量分数大于B物质的;
(2)过滤操作中需要用到的实验仪器和用品有:烧杯、铁架台(带铁圈)、漏斗、玻璃棒和滤纸;
(3)在实验室中,配制溶质质量分数为9%的氯化钠溶液100g,需要氯化钠固体的质量是![]() ;100g9%的氯化钠溶液中,含溶质
;100g9%的氯化钠溶液中,含溶质![]() ,要配成含氯化钠为0.9%的溶液,则稀释后溶液总质量为
,要配成含氯化钠为0.9%的溶液,则稀释后溶液总质量为![]() ,需要加水的质量为
,需要加水的质量为![]() 。
。


科目:初中化学 来源: 题型:
【题目】化学实验小组同学为研究某公共场所铁制护栏锈蚀的程度,将12.8g已生锈的铁片,放入一定浓度的稀盐酸中充分反应,测得产生的气体质量与稀盐酸的质量关系如下图所示(假设铁片除有Fe2O3外,不含其他杂质)。
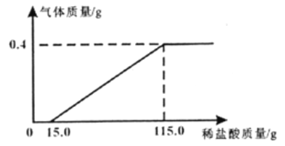
(1)生成氢气的质量为________g;
(2)所用稀盐酸中溶质的质量分数为________;
(3)计算该铁片中Fe2O3的质量分数为_______________(写出计算过程)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某研究小组为探究“铁丝和盐酸反应的快慢与什么因素有关”,取相同质量的铁丝和足量的盐酸反应得到下表中的三组实验数据,请回答下列问题:
实验编号 | 盐酸的质量分数/% | 反应温度/°C | 铁丝消失的时间/s |
① | 3 | 20 | 300 |
② | 6 | 20 | 200 |
③ | 6 | 40 | 40 |
(1)写出铁丝和盐酸反应的化学方程式:________________。
(2)实验②和③可探究________对铁丝和盐酸反应快慢的影响。若欲探究浓度对铁丝和盐酸反应快慢的影响,应选择的实验编号是____________。
(3)根据上表中的实验数据,可得出的结论是_______(写出一点即可)。
(4)如果把上表中实验②的反应温度改为25°C,请推测铁丝消失的时间t的取值范围:__________。
(5)实验除了用铁丝消失的时间来衡量反应的快慢外,你还能提出新的方法来衡量该反应的快慢吗?你的方法有________(写一点即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】生铁用途十分广泛。工业上利用赤铁矿(主要成分是 Fe2O3,还含少量 SiO2 等杂质)冶炼生铁的过程如下:

回答下列问题:
(1)生铁属于_____材料(填“合成”或“金属”)。“高炉气体”中的_____(填化学式)会导致酸雨。
(2)“煅烧”时:
①生成 CO 的反应之一为 C + CO2 ![]() 2CO,该反应属于_____反应(填基本反应类型)。
2CO,该反应属于_____反应(填基本反应类型)。
②用化学方程式表示利用 CO 炼铁的原理_____。
③CaCO3 和 SiO2 固体在高温条件下发生反应,生成 CO2 气体和 CaSiO3,该反应的化学方程式为_____。
(3)生活中铁制品锈蚀的过程,实际上是 Fe 与空气中_____、_____等发生化学反应的过程。下列措施能防止铁制品锈蚀的是_____(填标号)。
A 涂油、喷漆 B 镀耐腐蚀的铬层
C 用盐水清洗 D .久置于酸性环境
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)用途广泛,实验室以CuSO4为原料制备Cu2O步骤如下:
预热:分别预热CuSO4溶液和Na2SO3溶液。
反应:在玻璃反应器中混合上述两种溶液,热水浴,搅拌,同时控制反应液pH。
处理:自然冷却后过滤,用蒸馏水洗涤4~5次,在80℃真空干燥箱中烘干,保存产品。
已知:Cu2O在潮湿空气中会逐渐氧化成CuO。
(1)反应原理为2CuSO4+3Na2SO3![]() Cu2O↓+3_+2SO2↑。实验时,热水浴加热的优点是___。
Cu2O↓+3_+2SO2↑。实验时,热水浴加热的优点是___。
(2)实验中,反应温度、反应液pH对产物中Cu2O%的影响分别如图所示:
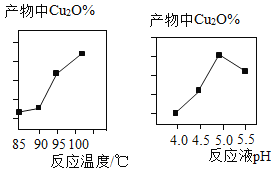
分析图像可知:最佳反应温度为____℃,该反应温度的优点有①____、②____。最佳反应液pH为_,若pH过低,产物中会有Cu杂质,则产物中Cu元素的质量分数将__(填“偏大”或“偏小”或“不变”)。
(3)产品洗净的标准是:取最后一次洗涤液,加入____(填试剂名称)溶液,若无白色沉淀产生,则说明已经洗净。
(4)产品烘干及保存要避免和潮湿空气接触,原因是____(填化学方程式)。
(5)工业上用CuSO4·5H2O制备Cu2O,若得到14.40吨Cu2O和一定质量的CuO(假设生产过程中Cu元素无损失),其中Cu2O和CuO的质量比为12:1,计算需要CuSO4·5H2O多少吨?写出计算过程,精确到小数点后两位)____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】探究铜生锈的条件
(提出猜想)根据铜锈的组成推测,铜生锈可能与CO2、H2O和O2有关。
(进行实验)实验小组同学取直径、长度均相同的铜丝,并打磨光亮。设计了如下图所示的5个实验并持续观察。
编号 | ① | ② | ③ | ④ | ⑤ |
实验 |
|
|
|
|
|
现象 | 无明显现象 | 无明显现象 | 铜丝表面有绿色物质 | 无明显现象 | 无明显现象 |
(解释与结论)
(1)实验中使用“经煮沸迅速冷却的蒸馏水”,其目的是_____。
(2)得出“铜生锈一定与O2有关”的结论,依据的两个实验是_____(填编号)。
(3)对比实验①和③,得出的结论是_____。
(4)为验证猜想,实验⑤广口瓶中除铜丝外,还应有的物质是_____。
(5)由上述实验可推知,铜生锈的条件是_____。
(反思与应用)
(6)结合上述实验,你对保存铜制品的建议是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】太阳能汽车利用太阳能来驱动,真正实现了零排放,有效地减少了对环境的污染,其产业的发展日益蓬勃。从某种意义上讲,太阳能汽车也是电动汽车的—种,所不同的是电动汽车的蓄电池靠工业电网充电,而太阳能汽车用的是太阳能电池。
(1)该太阳能汽车在白天给蓄电池充电的同时行驶,该行驶过程中首先____________能转化为化学能,然后转化为____________ 能,最终转化为机械能。
(2)该汽车车体主体材料是一种密度小、且抗腐蚀性好的一种合金,你认为下列材料中最合适的是___________( 填字母)
A 玻璃钢 B 锰钢 C 硬铝 D 生铁
(3)目前还有一种新能源汽车,氢燃料电池汽车,该种汽车的储氢材料是循环吸放氢过程中生成新的氢化物,其中一种为氢化铝锂(LiAlH4)的氢化物,在 125℃ 时分解为氢气和一种金属单质及氢化锂( LiH )。请你写出氢化铝锂分解反应的化学方程式______________。 反应前后铝元素的化合价分别为 ___________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知![]() 是初中化学常见的物质,B与人体血红蛋白结合会引起煤气中毒,C是赤铁矿的主要成分,H是胃酸的主要成分,它们之间的关系如下图所示。(图中“
是初中化学常见的物质,B与人体血红蛋白结合会引起煤气中毒,C是赤铁矿的主要成分,H是胃酸的主要成分,它们之间的关系如下图所示。(图中“![]() ”表示物质间转化关系,“—”两端物质间能相互反应。)请回答下列问题:
”表示物质间转化关系,“—”两端物质间能相互反应。)请回答下列问题:
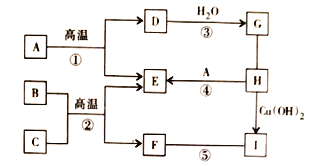
(1)写出I的化学式_____。
(2)判断⑤的反应类型_____。
(3)G的饱和溶液pH_____。
A 小于7 B 等于7 C 大于7 D 无法判断
(4)写出C与H反应的化学方程式_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室中有一瓶标签受损的无色液体,如图所示。这瓶无色液体是什么呢?实验员老师告诉大家,该液体可能是过氧化氢溶液、稀盐酸、稀硫酸和蒸馏水中的一种。
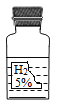
(1)大家讨论后一致认为不可能是蒸馏水,理由是_____;同时也不可能是稀盐酸,理由是_____。
(2)为确定该液体成分,同学们继续进行了如下实验探究:
实验操作 | 实验现象 | 实验结论 |
步骤一:取该液体适量于试管中,向其中加入_____ | _____ | 该液体不是过氧化氢溶液。 |
步骤二:_____ | _____ | 该液体是稀硫酸 |
(反思交流)
①大家认为标签受损的原因可能是_____;
②如果该液体是过氧化氢溶液,则步骤一中产生的变化用化学方程式表示为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com