
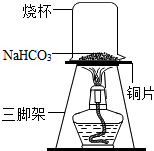
 糕点疏松剂的主要成分中含有碳酸氢钠,某化学兴趣小组对碳酸氢钠的化学性质进行探究.
糕点疏松剂的主要成分中含有碳酸氢钠,某化学兴趣小组对碳酸氢钠的化学性质进行探究.| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量加热后的固体产物放入试管A中,加入适量蒸馏水,充分振荡溶解,滴加足量氯化钙溶液,振荡,静置 | 产生白色沉淀 | 产物含Na2CO3 |
| ② | 取操作①后的上层清液于试管B中,滴加酚酞溶液 | 溶液不变色 | 产物不含NaOH |
分析 实验一:当溶液的pH等于7时,呈中性;当溶液的pH小于7时,呈酸性;当溶液的pH大于7时,呈碱性.
实验二:(3)检验生成物是NaOH还是Na2CO3,加入氯化钙溶液可以与碳酸钠反应产生沉淀的物质,据此进行分析解答.
(4)碳酸氢钠受热容易分解,生成水、二氧化碳气体和Na2CO3,写出反应的化学方程式即可.
解答 解:【实验探究一】用pH试纸测得碳酸氢钠溶液的pH为10,大于7,显碱性;
【实验探究二】(3)检验生成物是NaOH还是Na2CO3,加入足量的氯化钙溶液可以与碳酸钠溶液反应产生沉淀的物质,若有白色沉淀生成,说明固体产物是Na2CO3取反应后的上层清液,向其中滴加酚酞试液,酚酞试液不变红,说明溶液中不含氢氧根,说明固体产物中不含氢氧化钠;
(4)碳酸氢钠受热容易分解,生成水、二氧化碳气体和Na2CO3,反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
故答案为:
【实验探究一】碱;
【实验探究二】(3)
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量加热后的固体产物放入试管A中,加入适量蒸馏水,充分振荡溶解,滴加足量 氯化钙溶液,振荡,静置 | 产生白色沉淀 | 产物含Na2CO3 |
| ② | 取操作①后的上层清液于试管B中,滴加酚酞溶液 | 溶液不变色 | 产物不含NaOH |
点评 本题综合考查了碳酸钠、碳酸氢钠的知识,回答问题时,可以依据课本已有的知识,灵活应用,所以同学们在平时的学习中要加强知识的理解与应用.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
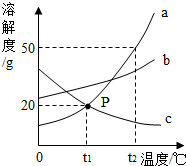 请根据图中a、b、c三种物质的溶解度曲线,回答下列问题:
请根据图中a、b、c三种物质的溶解度曲线,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com