
【题目】化学与生活密切相关,化学就在我们身边。
(1)下列食物中富含蛋白质的是_____________(填序号);
A牛肉
B 植物油
C米饭
D蔬菜
(2)生石灰常用作某些食品包装中的干燥剂,它的化学式为________________。
(3)野炊后用沙土盖灭火种的主要灭火原理是________________。
(4)用小苏打治疗胃酸过多症的化学方程式为________________。
科目:初中化学 来源: 题型:
【题目】t1℃时将甲、乙两固体物质分别按图1进行实验操作。请据图回答问题:
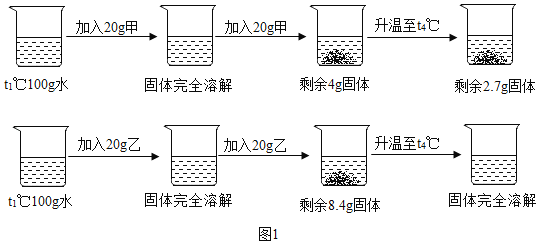
(1)甲物质溶解度曲线是图2中的_____(填A或B)、
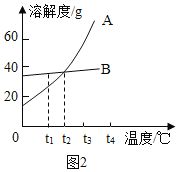
(2)t1℃时,甲物质的溶解度为_____g、
(3)t1℃时配制100g溶质质量分数为20%的甲的溶液,需要用到的玻璃仪器是_____、
①50mL量筒、胶头滴管、玻璃棒、烧杯
②100mL量筒、胶头滴管、玻璃棒、烧杯
(4)要配制溶质质量分数相同的甲,乙的饱和溶液,需要把温度控制在_____℃。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】石灰石是重要的矿石之一。学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份,进行实验,结果如下:
实验 | 1 | 2 | 3 | 4 |
加入样品的质量/g | 5 | 10 | 15 | 20 |
生成CO2的质量/g | 1.76 | 3.52 | 4.4 | m |
(1)哪几次反应中矿石中碳酸钙有剩余:________
(2)上表中m的数值是________
(3)试计算出这种石灰石矿中碳酸钙的质量分数________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室常利用以下装置完成气体制备及性质的探究实验。请回答下列问题:
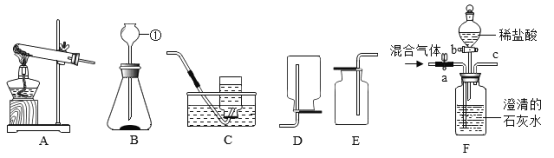
(1)指出编号①的仪器名称:_____。
(2)欲使用高锰酸钾制取氧气,应选择A装置,该反应的化学方程式表示为_____;为防止高锰酸钾粉末进入导管,应采取的措施是_____。
(3)将CO2和CO的混合气体通过F装置(液体药品均足量),实验开始时关闭活塞b,打开活塞a,此时从导管c逸出的气体主要是一氧化碳;一段时间后,再关闭活塞a,打开活塞b,将分液漏斗中的稀盐酸滴入瓶中,此时逸出的气体主要是_____,该反应的化学方程式表示为_____应选择的收集装置是_____,(填字母)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】黑火药是我国古代四大发明之一.黑火药爆炸的原理可以用下式表示:2KNO3+3C+S![]() K2S+N2↑+3X↑,根据质量守恒定律推断 X 的化学式为( )
K2S+N2↑+3X↑,根据质量守恒定律推断 X 的化学式为( )
A.CO2B.COC.NOD.SO2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学兴趣小组的同学在探究碱的化学性质时,完成了如图甲所示的两个实验。实验后,小明同学将废液倒入同一废液缸中,发现混合废液浑浊并显红色。请你完成下列问题:
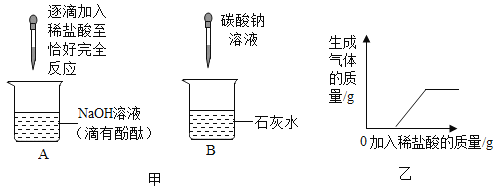
(1) A实验中发生反应化学方程式为____________________________。
(2) B实验中发生反应的现象是____________,反应的化学方程式为____________。
[提出问题]废液中,能使酚酞溶液变红的物质可能是哪些呢?
[作出猜想]
猜想一:废液中,能使酚酞溶液变红的物质可能是氢氧化钠;
猜想二:废液中,能使酚酞溶液变红的物质还可能是氢氧化钠和____________。
猜想三:废液中,能使酚酞溶液变红的物质还可能是氢氧化钠和氢氧化钙。
[实验验证]同学们对可能含有的碱性物质进行确定。取一定量的废液过滤,向滤液中逐滴加入稀盐酸,根据反应现象得到了如图乙所示的图象。
[结论]分析图象数据得出,废液中使酚酞溶液变红的物质一定是____________和____________,一定不是____________。
[拓展提高]为了使以上废液实现安全排放,你的做法是:____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请根据如图所示的实验回答下列问题:
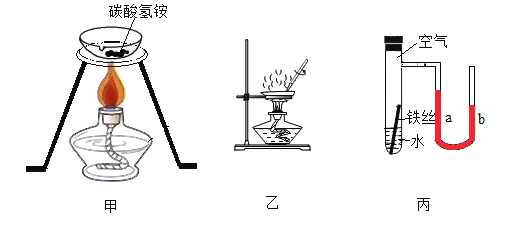
(1)甲是加热碳酸氢铵的实验。碳酸氢铵属于_____(选填“氮肥”“碳肥”或“复合肥”); 加热一会儿后,蒸发皿中固体完全消失,由此得出碳酸氢铵的一条化学性质是______。
(2)乙是蒸发氯化钠溶液的实验。当________时,停止加热。
(3)丙是验证铁丝锈蚀的实验。铁丝锈蚀的条件是_______;该实验开始时U形管两端液面相平,一段时间后,能观察到液面的变化为_____(选填“a”或“b” )下降。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为验证酸碱盐和氧化物的性质与转化,某同学设计如下实验(试管A中如入过量稀硫酸)。
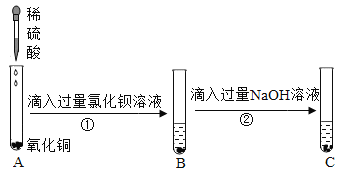
(1)试管A中观察到的现象是 ____________________。
(2)反应①的化学方程式是_____________________________(写一个)。
(3)反应②刚开始观察不到明显现象,其原因是____________________________。
(4)试管C与A中固体的质量关系是A________C(选填“>”“<"或”=”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下列科普短文并回答问题:

纯碱的用途非常广泛。纯碱工业始创于18 世纪,西方国家对这一技术采取了严格的保密措施。一些专家想探索此项技术的秘密,均以失败告终。1943年,我国化学工程专家侯德榜针对西方纯碱生产时食盐利用率低,制碱成本高,废液、废渣污染环境和难以处理等不足,发明了侯氏制碱法又称联合制碱法。
发明原理
第一步:氨气与水和二氧化碳反应生成一分子的碳酸氢铵。先添加NH3而不是CO2:CO2在NaCl中的溶解度很小,先通入NH3使食盐水显碱性(用无色酚酞溶液检验),能够吸收大量CO2气体。
第二步:碳酸氢铵与氯化钠反应生成氯化铵和碳酸氢钠沉淀。
第三步:在5℃~ 10℃时,向母液中加入食盐细粉,而使NH4Cl单独结晶析出供做氮肥。向时液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用是:①增大NH4+的浓度,使NH4Cl更多地析出②使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度。联合法综合利用了合成氨的原料,提高了氯化钠的利用率,减少了环境污染。NH3、CO2 都来自于合成氨工艺:这样NH4Cl就成为另一产品化肥。综合利用原料、降低成本、减少环境污染,NaCl利用率达96%。
第四步:加热碳酸氢钠制取纯碱。
温度溶解度物质 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
NH4HCO3 | 11.9 | 16.1 | 21.7 | 28.4 | 36.6 | 44.1 | 59.2 |
NaHCO3 | 6.9 | 8.15 | 9.6 | 11.1 | 12.7 | 14.4 | 16.4 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |

阅读短文,回答下列问题:
(1)写出侯氏制碱法第二步的化学反应方程式_____。
(2)饱和食盐水中持续通入氨气和二氧化碳气体后,溶液中大量存在的离子有_____。
(3)第二步的复分解反应发生时,常温下向溶液中持续通入氨气和二氧化碳气体,碳酸氢钠以沉淀的形式先析出的原因是_____。
(4)写出侯氏制碱法的一个优点_____。
(5)循环利用的物质是_____。
(6)侯氏制碱法中没有涉及的化学反应类型是_____。
(7)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com