
【题目】水是生命之源,也是人类最宝贵的资源。
(1)下图是水电解过程的示意图,微粒运动变化的先后顺序是______
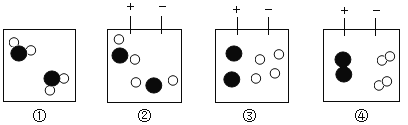
由质量守恒定律可知,以下在化学变化中不会发生改变的是______
A 原子种类 B 分子种类 C 原子个数 D 元素种类 E 物质种类
由此可知,化学变化的本质是______。
(2)实验过程中,正极产生的气体是______(填化学式),正负极气体的质量比为______。写出该反应的化学方程式______。
(3)某些地方的水质较硬,烧水时,水壶很容易结水垢,生活中可用______清洗水壶中的水垢。
【答案】①②③④ ACD 分子分成原子,原子再重新组合成新的分子 O2 8:1 2H2O![]() 2H2↑+O2↑ 食醋
2H2↑+O2↑ 食醋
【解析】
(1)水电解的过程可用下列图示表示,微粒运动变化的先后顺序是:水分子分解成氢原子和氧原子,氢原子和氢原子结合成氢分子,氧原子和氧原子结合成氧分子。顺序是:①②③④;由质量守恒定律可知,在化学反应前后,原子的种类、数目和质量不变,元素的种类也不变,分子的种类一定改变;物质的种类一定改变;由此可知,化学变化的本质是分子分成原子,原子再重新组合成新的分子;故填:①②③④;ACD;分子分成原子,原子再重新组合成新的分子;
(2)电解水时,正极产生的气体是氧气,负极产生的是氢气,氧气与氢气的质量比为32:(2×2)=8:1;水在通电的条件下分解为氢气和氧气;故填:O2;8:1;
2H2O![]() 2H2↑+O2↑;
2H2↑+O2↑;
(3)水垢能与醋酸反应,所以可用食醋来除去水壶中的水垢;故填:食醋。


科目:初中化学 来源: 题型:
【题目】氧锰八面体纳米棒(OMS-2)是一种新型的环保催化剂。用软锰矿和黄铁矿(主要成分分别为 MnO2、FeS2)合成 OMS-2 的工艺流程如下:
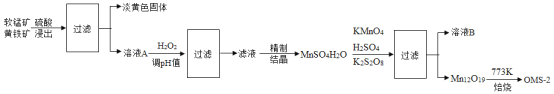
(1)为加快反应速率,软锰矿和黄铁矿需进行的预处理是________ 。
(2)淡黄色固体是一种非金属单质,化学式为_______。“调 pH 并过滤”主要除去________元素(写出元素名称)。
(3)Mn12O19 中氧元素化合价均为-2 价,锰元素的化合价有两种+3价和+4价,则显+3 价、+4 价的锰元素的原子个数之比为________。生产过程中的反应方程式如下并配平该方程式。其中化学方程式中 KMnO4、K2S2O8、MnSO4的化学计量数比为1:1:5。
_______ KMnO4+_______ K2S2O8+_______ MnSO4+_______ H2O=_______ K2SO4+_______ Mn12O19+_______ H2SO4
(4)确定 Mn12O19已洗净的方法为:取最后一次洗涤液,加入________,观察到现象为_______时,则已洗净。溶液 B 可进一步分离出两种主要化合物,一种可在该工艺中循环使用,化学式是_______;另一种为盐类,在农业生产中可用作_______ 。
(5)OMS-2 是一种纳米级的分子筛。分别用 OMS-2 和 MnOx 对甲醛进行催化氧化,在相 同时间内甲醛转化率和温度的关系如图:
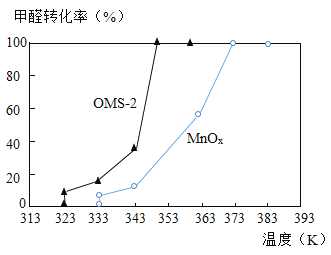
由图可知,OMS-2 与 MnOx 相比,催化效率较高是_______。(填“OMS-2”或“MnOx”)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】学完金属的化学性质后,小华用下列仪器和试剂验证影响金属与硫酸反应速率的因素:
仪器:烧杯、试管夹、酒精灯、药匙、托盘天平,镊子。
药品:铝丝、铁丝、铁粉、6%硫酸、25%硫酸。
Ⅰ、不同状态的金属与酸反应的速率不同
取质量相等的铁丝和铁粉,分别放入等浓度,等体积的稀盐酸中,生成氢气的质量(m)与反应时间(t)的关系曲线如图所示。

(1)为完成该实验,需要补充的一种仪器是_______ 。
(2)曲线B对应的物质是_____。
(3)请写出铁与稀硫酸反应的化学方程式:_______________。
(4)由此实验得到的结论是__________________。
Ⅱ、金属与不同溶质质量分数的硫酸反应的速率不同
取质量相等的铁丝,分别放入6%、25%的等量且足量稀硫酸中。请画出生成氢气的质量与反应时间的关系曲线图。__________
Ⅲ、______对金属与盐酸的反应速率也有影响
实验设计:___________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下表是元素周期表中的1~18号元素原子核外电子排布,我们对它进行研究:
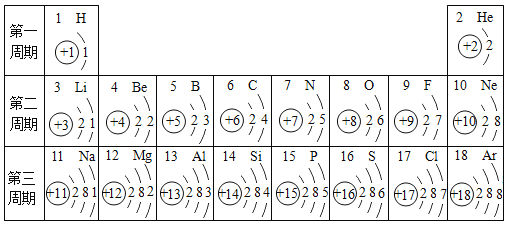
(1)从原子结构上分析,图中氧、硫元素具有相似化学性质的主要原因是 ;
(2)写出质子数为1、6、8、11四种元素组成的可以治疗胃酸过多物质的化学式: 。
(3)![]() 表示一种元素的两种粒子,它们属于同一种元素的依据是 。
表示一种元素的两种粒子,它们属于同一种元素的依据是 。
(4)图中He与Ne、Ar原子最外层电子数不一样,但都处在每周期的结尾处,从原子结构上分析其原因 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】中国航空业快速发展,先进无人机亮相阅兵式,大飞机C919首飞成功,新型材料也得到广泛应用。
(1)用来制造无人机的碳纤维复合材料属于_____(填“纯净物”或“混合物”)。自然界中存在碳﹣12、碳﹣13、碳﹣14三种不同的原子,这三种原子都属于同种元素的原因是_____。
(2)某种无人机的动力来源于钾电池,锂电池的工作原理是FePO4+Li![]() LiFePO4.则锂电池放电时的反应类型是_____反应;在LiFePO4中锂元素显+1价,磷元素显+5价。则铁元素的化合价是_____。
LiFePO4.则锂电池放电时的反应类型是_____反应;在LiFePO4中锂元素显+1价,磷元素显+5价。则铁元素的化合价是_____。
(3)大飞机C919发动机上的压气机将高密度空气(高压压缩后的空气)压入燃烧室,能促进航空煤油燃烧,使燃油消耗减少16%.壬烷(C9H12)是煤油的成分之一,它完全燃烧的化学方程式为_____,请你从微观角度解释高密度空气能使航空煤油燃烧更充分的原因是_____,应用该技术的重要意义是_____(作答一点)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】加热![]() 制备
制备![]() 并用排水法收集氧气的实验完毕后,应先将导管从水槽中移出,后熄灭酒精灯。很据上述示例,写出下列实验操作中的“先”与“后”关系:
并用排水法收集氧气的实验完毕后,应先将导管从水槽中移出,后熄灭酒精灯。很据上述示例,写出下列实验操作中的“先”与“后”关系:
(1)稀释浓硫酸时:应先在烧杯中_____,后_____。
(2)连接好气体发生装置后,检查装置气密性的操作:应该先_____,后_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校实验室有一无色澄清溶液,其中除了硝酸钠以外,可能还含有氢氧化钠、碳酸钠、硝酸钡中的一种或几种。
实验活动一:探究该废液的组成。
取一定量的无色溶液(废液),进行如下图所示实验。

请回答下列问题:
(1)原无色废液呈_____(填“酸性”、“碱性”或“中性”),操作1的名称为_____。
(2)生成固体甲的化学方程式为_____。
(3)原无色澄清废液中一定没有_____(写名称或化学式均可)。
实验活动二:处理废液得到较纯净的硝酸钠溶液。
将溶液A和原无色废液充分混合,无明显现象。接下来进行如下实验。
a.向混合溶液中加入过量的氢氧化钠溶液,再加入过量的试剂①,过滤后得到固体乙和溶液B。
b.向实验步骤a中得到的溶液B中加入适量的试剂②,得到了含少量指示剂的硝酸钠溶液。
回答下列问题:
(1)混合后废液中一定含有的溶质是(指示剂除外)_____。
(2)试剂①是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学来源于生活,化学与生活密切相关。
(1)电解水过程中不变的微粒是_____(填化学用语),写出该反应的化学方程式_____。
(2)农业生产中,如果农作物缺少钾元素,会出现_____(填序号)。
A 叶色不浓绿 B 茎杆不粗壮 C 根系不发达
(3)铁制品锈蚀的过程,实际上是铁跟空气中的_____发生化学反应的过程;可用稀硫酸除去其表面的铁锈,反应的化学方程式为_____
(4)自来水是通过水厂生产出来符合相应标准的供人们生活、生产使用的水。其生产过程中加入液氯的作用为_____。
(5)铝合金可用于制造飞机的外壳, 铝合金属于_____材料
(6)锰钢属于铁合金,可用于制造钢轨。已知锰的金属活动性介于镁与锌之间,如果用实验比较铁和锰的金属活动性强弱,下列所给试剂组能够达到目的的是_____(填字母序号)。
A Fe、Mn、10%硫酸溶液 B Fe、Mn、MgSO4溶液
C Fe、Mn、ZnSO4溶液 D Cu、FeSO4溶液、MnSO4溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国著名化学家侯德榜先生发明了“侯氏制碱法”,其原理中重要的一步是向饱和食盐水中先后通入足量NH3和CO2制备NaHCO3,化学方程式:NaCl+ NH3+CO2+H2O= NaHCO3↓+NH4Cl
某兴趣小组在实验室模拟该过程,请结合具体的步骤回答下列问题:
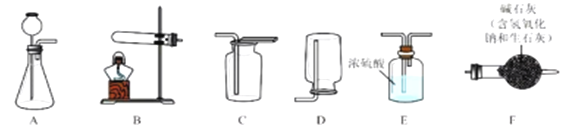
I.气体制备
(1)二氧化碳气体制备
实验室常采用石灰石与稀盐酸反应制备CO2,其化学方程式为_____________。应选择的气体收集装置为______(选填装置对应的字母)。
(2)氨气制备
实验室常用硫酸吸收氨气,防止污染空气,实验室制备NH3的反应原理为:Ca(OH)2(固)+2NH4Cl(固) ![]() CaCl2+2H2O+2NH3↑。现要制备并干燥NH3,所选装置的正确连接顺序为_____→______(选择装置对应的字母)。实验室制备O2也可用上述制备NH3的发生装置,写出用该发生装置制备O2的化学方程式__________。
CaCl2+2H2O+2NH3↑。现要制备并干燥NH3,所选装置的正确连接顺序为_____→______(选择装置对应的字母)。实验室制备O2也可用上述制备NH3的发生装置,写出用该发生装置制备O2的化学方程式__________。
II.NaHCO3制备
物质 | NaHCO3 | NH4Cl |
溶解度/g(20℃) | 9.6 | 37.2 |
(3)根据表格中的溶解度数据,解释20℃产物中NaHCO3能够先从溶液中结晶析出的原因________。
(4)该过程中另一产物NH4Cl在农业生产中常被用作______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com