
ijĶ¬Ń§ĪŖĮĖ²ā¶Ø»ĘĶŠ¼£ØÓÉŠæŗĶĶŠĪ³ÉµÄŗĻ½š£©ŃłĘ·×é³É£¬Č”ĖÄ·ŻŃłĘ··Ö±š¼ÓĻ”ĮņĖį·“Ó¦£¬Ę䏵Ń鏿¾Ż¼ĒĀ¼ČēĻĀ±ķ”£
| ѳʷ | µŚ1·Ż | µŚ2·Ż | µŚ3·Ż | µŚ4·Ż |
| Ȕѳʷ֏Įæ£Øg£© | 50£®0 | 50£®0 | 50£®0 | 50£®0 |
| Č”Ļ”ĮņĖįÖŹĮæ£Øg£© | 40£®0 | 80£®0 | 120£®0 | 160£®0 |
| ²śÉśĘųĢåÖŹĮæ£Øg£© | 0£®4 | 0£®8 | 1£®0 | 1£®0 |
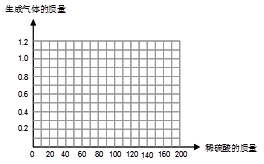
£Ø1£©Ļ”ĮņĖį £Ø2·Ö£©
£Ø2£©65% £Ø1·Ö£©
½āĪöŹŌĢā·ÖĪö£ŗ£Ø1£©“Ó±ķÖŠµÄŹż¾ŻæÉŅŌ擳ö£¬50gŗĻ½š×ī¶ąæÉŅŌŗĶ100gĻ”ĮņĖį·“Ó¦Ē”ŗĆĶźČ«·“Ó¦£¬Éś³É1£®0gĒāĘų£¬ĖłŅŌµŚŅ»”¢¶ž“ĪĻ”ĮņĖį·“Ó¦ĶźĮĖ£¬½šŹōÓŌŹ£Óą£»µŚČż”¢ĖÄ“Ī½šŹō·“Ó¦ĶźĮĖ£¬Ļ”ĮņĖįÓŠŹ£Óą£Ø2£©ĻČøł¾Ż1£®0gĒāĘųµÄÖŹĮæĒó³öŠæµÄÖŹĮæĪŖ32£®5g£¬ŌŁÓĆ32£®5g³żŅŌ50g¾ĶµĆ³öѳʷ֊ŠæµÄÖŹĮæ·ÖŹż£Ø3£©µ±Ļ”ĮņĖįĪŖ40gŹ±£¬ĒāĘųĪŖ0£®4g£»Ļ”ĮņĖįĪŖ80gŹ±£¬ĒāĘųĪŖ0£®8g£»ŅŌ“ĖĄąĶĘ£¬Ļ”ĮņĖįĪŖ100gŹ±£¬ĒāĘųĪŖ1£®0g£»Ļ”ĮņĖį“óÓŚ100gŹ±ĒāĘųČŌČ»ŹĒ1£®0g£¬Ćč³öÕā¼øøöµćŗóŌŁĮ¬½ÓĘšĄ“¾ĶæÉŅŌĮĖ
æ¼µć£ŗøł¾ŻŹż¾Ż½ųŠŠ·ÖĪöŗó£¬ŌŁ½ųŠŠ»Æѧ·½³ĢŹ½µÄ¼ĘĖć


 ĆūŠ£æĪĢĆĻµĮŠ“š°ø
ĆūŠ£æĪĢĆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
Ęū³µĪ²ĘųÅŷųöµÄĘųĢåÖ÷ŅŖÓŠNOŗĶNO2,ĖüĆĒĪŪČ¾»·¾³,æÉÓĆ°±Ęų(NH3)³żČ„”£
·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ:2NH3 + NO + NO2“߻ƼĮ 2N2 +3H2O”£Čō·“Ó¦ŗóµĆµ½56g N2,ĄķĀŪ
ÉĻĻūŗÄ°±Ęų¶ąÉŁæĖ?
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
”°¹żĢ¼ĖįÄĘ”±£Ø»ÆѧŹ½æɱķŹ¾ĪŖ2Na2CO3?3H2O2£©Ė×³Ę¹ĢĢåĖ«ŃõĖ®£¬¼«Ņ×·Ö½ā£¬Ėü¼ČÓŠĢ¼ĖįŃĪµÄŠŌÖŹ£¬ÓÖÓŠĖ«ŃõĖ®µÄ²»ĪČ¶ØŠŌŗĶŃõ»ÆŠŌ£¬ŹĒŗÜŗƵÄĻū¶¾¼ĮŗĶ¹©Ńõ¼Į£¬¹ć·ŗÓ¦ÓĆÓŚĻ“µÓ”¢Ó”Č¾ŗĶŅ½Ņ©µČĮģÓņ£®ĻÖ½«Ņ»¶ØÖŹĮæµÄ¹żĢ¼ĖįÄĘ·ŪÄ©ČÜÓŚmæĖĖ®ÖŠÅä³ÉĻ”ČÜŅŗ£¬ŌŁĻņĘäÖŠ¼ÓČėŹŹĮ涞Ńõ»ÆĆĢ·ŪÄ©£¬³ä·Ö·“Ó¦ŗóÉś³É4.8gĘųĢ壮½«·“Ó¦ŗóµÄ»ģŗĻĪļ¹żĀĖ£¬²āµĆĀĖŅŗµÄČÜÖŹÖŹĮæ·ÖŹżĪŖ10.6%£¬Ēóm£®£Ø²»æ¼ĀĒĖšŗÄ£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
Ēėøł¾ŻĻĀĶ¼ĖłŹ¾µÄŹµŃé¹ż³ĢŗĶĢį¹©µÄŹż¾Ż£Ø²½Öč¢Ś²śÉśµÄĘųĢåČ«²æŅŻ³ö£©£¬»Ų“šĻĀĮŠĪŹĢā£ŗ£ØCaCl2ČÜÓŚĖ®£¬µ«²»ÓėĻ”ŃĪĖį·“Ó¦£©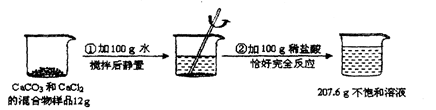
¼ĘĖćŌ»ģŗĻĪļѳʷ֊CaCl2µÄÖŹĮæ£ØŠ“³ö¼ĘĖć¹ż³Ģ£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
ĪŖĮĖ²ā¶Øij·Ūĩד»ĘĶ£ØĶ”¢ŠæŗĻ½š£©ŃłĘ·ÖŠĶµÄÖŹĮæ·ÖŹż£¬±“±“Ķ¬Ń§Č”10g»ĘĶѳʷ·ÅČėÉÕ±ÖŠ£¬ŌŁČ”40gĻ”ŃĪĖį·ÖĖÄ“Ī¼ÓČėÉÕ±ÖŠ£¬¾ł³ä·Ö·“Ó¦£¬ŹµŃ鏿¾ŻČēĻĀ£ŗ
| | µŚŅ»“Ī | µŚ¶ž“Ī | µŚ¶ž“Ī | µŚĖÄ“Ī |
| ¼ÓČėĻ”ŃĪĖįÖŹĮæ£Øg£© | 10g | 10g | 10g | 10g |
| Ź£Óą¹ĢĢåµÄÖŹĮæ£Øg£© | 8.7g | 7.4g | 6.1g | 5.45g |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
ÓĆĀČ»ÆÄĘŗĶĢ¼ĖįĒāļ§£ØNH4HCO3£©æÉÖʱøĢ¼ĖįĒāÄĘŗĶĀČ»Æļ§£ØNH4Cl£©£¬øĆ·“Ó¦æɱķŹ¾ĪŖ£ŗNaCl+NH4HCO3ØTNaHCO3+NH4Cl£®
20”ꏱ£¬°“ÉĻŹö»Æѧ·½³ĢŹ½ÖŠ·“Ó¦ĪļµÄÖŹĮæ±Č£¬Ļņ100gĖ®ÖŠ¼ÓČė11.7g NaCl
ŗĶ15.8g NH4HCO3£®Ēė¼ĘĖć£ŗ
£Ø1£©ĄķĀŪÉĻ“ÓČÜŅŗÖŠĪö³ö¾§ĢåµÄÖŹĮæĪŖ¶ąÉŁg£æ
£Ø2£©·“Ó¦ŗóĖłµĆČÜŅŗÖŠČÜÖŹNH4ClµÄÖŹĮæ·ÖŹżŹĒ¶ąÉŁ£æ£ØŠ“³ö¼ĘĖćŹ½¼“æÉ£©£®
׏ĮĻ£ŗ20”ꏱĖÄÖÖĪļÖŹµÄČܽā¶ČČēĻĀ£¬¼ŁÉčĖüĆĒĶ¬Ź±ČܽāŌŚĖ®ÖŠø÷×ŌµÄČܽā¶Č²»±ä£®
| ĪļÖŹ | NaCl | NH4HCO3 | NH4Cl | NaHCO3 |
| Čܽā¶Č/g | 36.0 | 21.6 | 37.2 | 9.6 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
øł¾ŻŗīµĀ°ńÖĘ¼ī·ØŌĄķ£¬ŹµŃéŹŅÖʱø“æ¼ī(Na2CO3)µÄÖ÷ŅŖ²½ÖčŹĒ£ŗ£ŗ½«ÅäÖĘŗƵı„ŗĶNaClČÜŅŗµ¹ČėÉÕ±ÖŠ¼ÓČČ£¬æŲÖĘĪĀ¶ČŌŚ30-35”ę£¬½Į°čĻĀ·ÖÅś¼ÓČėŃŠĻøµÄNH4HCO3¹ĢĢ壬¼ÓĮĻĶź±Ļŗ󣬼ĢŠų±£ĪĀ30·ÖÖÓ£¬¾²ÖĆ”¢¹żĀĖµĆNaHCO3¾§Ģ唣ÓĆÉŁĮæÕōĮóĖ®Ļ“µÓ³żČ„ŌÓÖŹ£¬¾¹ż“¦Ąķŗó£¬×ŖČėÕō·¢ĆóÖŠ£¬×ĘÉÕ2Š”Ź±£¬µĆNa2CO3¹ĢĢ唣
ĖÄÖÖŃĪŌŚ²»Ķ¬ĪĀ¶ČĻĀµÄČܽā¶Č£Øg£©±ķ
 ĪĀ¶Č ĪĀ¶Č Čܽā¶Č ŃĪ | 0”ę | 10”ę | 20”ę | 30”ę | 40”ę | 50”ę | 60”ę | 100”ę |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | ¢Ł | ”Ŗ”Ŗ | ”Ŗ”Ŗ | ”Ŗ”Ŗ |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | ”Ŗ”Ŗ |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
|
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
NaOH³±½āŗó¼«Ņ×ÓėæÕĘųÖŠµÄCO2·“Ӧɜ³ÉNa2CO3¶ų±äÖŹ£®ĪŖ²ā¶ØŹµŃéŹŅŅ»Ęæ·ÅÖĆŅŃ¾ĆµÄÉÕ¼īÖŠNaOHŗ¬Į棬ijĶ¬Ń§Č”ŹŹĮæµÄÉÕ¼īѳʷ£¬ČÜÓŚŅ»¶ØĮæµÄĖ®µĆµ½200gČÜŅŗ£»ŌŁ¼ÓČė200gĻ”ĮņĖį£Ø×ćĮ棩³ä·Ö½Į°čµ½²»ŌŁ·Å³öĘųÅŻĪŖÖ¹£¬³ĘĮæČÜŅŗĪŖ395.6g£®
Ēė¼ĘĖć£ŗ
£Ø1£©·“Ó¦²śÉśµÄCO2µÄÖŹĮæĪŖ g£®
£Ø2£©ČōĖłČ”ÉÕ¼īѳʷĪŖ50.0g£¬Ōņѳʷ֊NaOHµÄÖŹĮæ·ÖŹżŹĒ¶ąÉŁ£æ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
ĒāĘų»¹ŌŃõ»ÆĶÉś³ÉŗģÉ«¹ĢĢ壬ÕāŠ©ŗģÉ«¹ĢĢåŹĒŹ²Ć“ĪļÖŹ£æijæĘѧŠĖȤŠ”×é²éŌÄ׏ĮĻµĆÖŖ£¬·“Ó¦ĪĀ¶Č²»Ķ¬£¬ĒāĘų»¹ŌŃõ»ÆĶµÄ²śĪļæÉÄÜŹĒCu»ņCu2O£¬CuŗĶCu2O¾łĪŖ²»ČÜÓŚĖ®µÄŗģÉ«¹ĢĢ壬µ«Ńõ»ÆŃĒĶÄÜÓėĻ”ĮņĖį·“Ó¦£¬»Æѧ·½³ĢŹ½ĪŖ£ŗCu2O+H2SO4ØTCuSO4+Cu+H2OĪŖĢ½¾æ·“Ó¦ŗóµÄŗģÉ«¹ĢĢåÖŠŗ¬ÓŠŹ²Ć“ĪļÖŹ£æĖūĆĒĢį³öĮĖŅŌĻĀ¼ŁÉč£ŗ
¼ŁÉčŅ»£ŗŗģÉ«¹ĢĢåÖ»ÓŠCu
¼ŁÉ趞£ŗŗģÉ«¹ĢĢåÖ»ÓŠCu2O
¼ŁÉčČż£ŗŗģÉ«¹ĢĢåÖŠÓŠCuŗĶCu2O
Ēė»Ų“šÓŠ¹ŲĪŹĢā£ŗ
£Ø1£©Č”ÉŁĮæŗģÉ«¹ĢĢ壬¼ÓČė×ćĮæµÄĻ”ĮņĖį£¬ČōĪŽĆ÷ĻŌĻÖĻó£¬Ōņ¼ŁÉč ³ÉĮ¢£»Čō擵½ČÜŅŗ±ä³ÉĄ¶É«£¬ĒŅČŌÓŠŗģÉ«¹ĢĢ壬ŌņÄÜ·ńÖ§³Ö¼ŁÉčČż£æ £ØŃ”Ģī”°ÄÜ”±»ņ”°²»ÄÜ”±£©
£Ø2£©ĻÖ½«3æĖŗģÉ«¹ĢĢå¼ÓČė×ćĮæµÄĻ”ĮņĖįÖŠ£¬·“Ó¦ŗóµÄČÜŅŗ¹żĀĖ£¬³ĘµĆŗęøÉŗóµÄĀĖŌüÖŹĮæĪŖ1.4æĖ£¬ŌņŌŗģÉ«¹ĢĢåÖŠŗ¬ÓŠŹ²Ć“ĪļÖŹ£æ £®
²éæ““š°øŗĶ½āĪö>>
¹ś¼ŹŃ§Š£ÓÅŃ” - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com