
【题目】无水氯化镁是制备某种催化剂的中间体。某研究性学习小组设计实验方案进行制取无水氯化镁等实验。请填写下列空白。
(1)[实验一]
利用下图实验装置(夹持和加热装置省略) , 在HCl气流中小心加热MgCl2. 6H2O晶体制取无水氯化镁(无水氯化镁易吸水)。烧瓶中发生的反应为:![]() 。
。
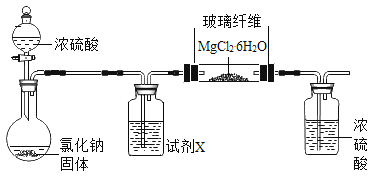
①试剂X是____。第二个洗气瓶中的浓硫酸的作用是_____。
②该实验装置存在一个缺陷是___。
(2)[实验二]
通过下列步骤,测定实验一所得产物中氯元素含量以确定产物是否含有结晶水:
称取m1 g样品置于烧杯中,充分溶解;加入足量硝酸银溶液,充分反应后,过滤;洗涤沉淀,干燥至恒重,称得沉淀质量为m2 g。
①若步骤③的操作中未洗涤沉淀,将导致测得的氯元素含量___ ( 填“偏高”或“偏低”)。
②若测得m1=10.40,m2=28.70,则所得产品MgCl2.nH2O中n的值为___。
(3)[实验三]
一定条件下,氯化镁与四氯化钛的混合物可作烯烃聚合反应的催化剂。为了探究温度、氯化镁固体的含水量以及粉碎方式对该催化剂催化效果的影响,设计如下对比实验:
实验序号 | 氯化镁固体中氯元素含量/% | 温度/°C | 粉碎方式 | 催化效果/g.g-1 |
1 | 70.97 | 20 | 滚动球磨 |
|
2 | 74.45 | 20 | 滚动球磨 |
|
3 | 74.45 | 20 | 振动球磨 |
|
4 | ω | 100 | 振动球磨 |
注:催化效果用单位时间内每克催化剂得到产品的质量来表示
①表中ω=_____。
②从实验1、2可以得出的结论是_______。
③设计实验2、3的目的是___。
【答案】浓H2SO4 吸收空气中的水,防止MgCl2水解 无尾所处理装置, HCl会进入空气,造成污染 偏高 0.5 74.45 其它条件相同时,氯化镁固体氯含量越高,催化效果越好 探究其它条件相同时,粉碎方式对催化效果的影响
【解析】
(1)①烧瓶中发生的反应为:NaCl+H2SO4(浓)=NaHSO4+HCl↑,制得的氯化氢气体中含有水蒸气,氯化镁中的镁离子易水解,需用浓硫酸干燥氯化氢,所以X为浓硫酸。第二个瓶中的浓硫酸可以防止空气中的水进入到玻璃管中,可以防止MgCl2水解。
②氯化氢是污染性气体,故该装置中缺少尾气处理装置。
(2)①若步骤③的操作中未洗涤沉淀,杂质误计入氯化银沉淀,故测量结果偏大。
②m1=10.40是样品质量,m2=28.70是AgCl质量,n(AgCl)=![]() =
=![]() =0.2mol,2n(AgCl)=n(MgCl2),n(MgCl2)=0.1mol,m(MgCl2)=9.5g,则n(H2O)=
=0.2mol,2n(AgCl)=n(MgCl2),n(MgCl2)=0.1mol,m(MgCl2)=9.5g,则n(H2O)=![]()
=0.05mol,n(MgCl2)=0.1mol,则n(MgCl2):n(H2O)=1:0.5
,即n=0.5
(3)①做对比实验时只能改变一个条件,由表中数据可知,实验4中温度为100℃,所以与实验3比较其它条件不变,则ω=74.45,故答案为:74.45;
②实验1中氯元素含量低,则水的含量高,对应的催化效果差,所以氯化镁固体含水量越高,催化剂催化效果越差,故答案为:氯化镁固体含水量越高,催化剂催化效果越差;
③实验2、3中改变的条件中只有粉碎方式不同,其它都相同,所以实验2、3的目的是探究粉碎方式对催化剂催化效果的影响,
故答案为:探究粉碎方式对催化剂催化效果的影响.


科目:初中化学 来源: 题型:
【题目】如图是“汽车尾气催化转换器”将汽车尾气中的有毒气体转化为无毒气体的微观模拟图,请回答下列问题:
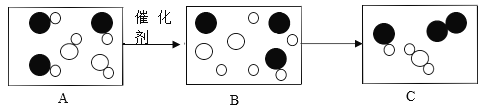

(1)在C图中将相关的粒子补充完整; __________
(2)此变化前后未发生改变的粒子是________。
(3)此反应中反应物均属于氧化物的微观判断依据是_____。
(4)画出比1个一氧化氮分子多3个电子,且带一个单位负电荷的粒子的结构示意图_。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学实验小组同学为研究某公共场所铁制护栏锈蚀的程度,将12.8g已生锈的铁片,放入一定浓度的稀盐酸中充分反应,测得产生的气体质量与稀盐酸的质量关系如下图所示(假设铁片除有Fe2O3外,不含其他杂质)。
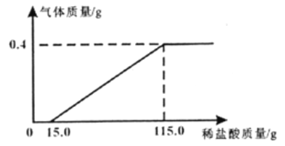
(1)生成氢气的质量为________g;
(2)所用稀盐酸中溶质的质量分数为________;
(3)计算该铁片中Fe2O3的质量分数为_______________(写出计算过程)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某种镀锡铜线表面锡的褪除及回收的工艺流程如图所示,请回答以下问题:
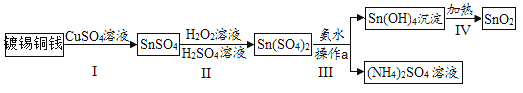
(1)Sn(OH)4中锡(Sn)的化合价为_________________。
(2)步骤Ⅲ中操作a的名称是_____________,该操作中用到的一种玻璃仪器的名称是______________。
(3)写出过程I中发生反应的化学方程式:_____________;过程IV发生的反应的基本反应类型是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙、丙三种物质的溶解度曲线,下列分析错误的是
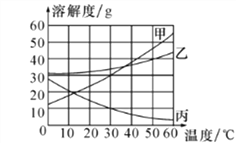
A. 30℃时,把10g丙溶解在50g水中,得到丙的饱和溶液
B. 50℃时,把甲、乙、丙三种溶液降温至10℃,析出晶体的质量由大到小的顺序为:甲>丙>乙
C. 将甲的饱和溶液变为不饱和溶液,可采用升高温度的方法
D. 30℃时,甲的饱和溶液的溶质质量分数约为23.1%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某课外活动小组对失去标签的稀硫酸浓度进行测定:取稀硫酸50 g于烧杯中,逐滴滴加3.42%的氢氧化钡溶液,烧杯内溶质质量与滴加氢氧化钡溶液质量关系如图所示。( 结果保留两位小数)
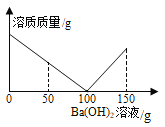
(1)参加反应的Ba(OH)2质量共有_______g。当滴加Ba(OH)2溶液50g时,烧杯内溶液的pH__________7(填“>”“<”或“=”)。
(2)求该硫酸溶液的溶质质量分数 ( 写出答题过程,结果保留0.01%)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某研究小组为探究“铁丝和盐酸反应的快慢与什么因素有关”,取相同质量的铁丝和足量的盐酸反应得到下表中的三组实验数据,请回答下列问题:
实验编号 | 盐酸的质量分数/% | 反应温度/°C | 铁丝消失的时间/s |
① | 3 | 20 | 300 |
② | 6 | 20 | 200 |
③ | 6 | 40 | 40 |
(1)写出铁丝和盐酸反应的化学方程式:________________。
(2)实验②和③可探究________对铁丝和盐酸反应快慢的影响。若欲探究浓度对铁丝和盐酸反应快慢的影响,应选择的实验编号是____________。
(3)根据上表中的实验数据,可得出的结论是_______(写出一点即可)。
(4)如果把上表中实验②的反应温度改为25°C,请推测铁丝消失的时间t的取值范围:__________。
(5)实验除了用铁丝消失的时间来衡量反应的快慢外,你还能提出新的方法来衡量该反应的快慢吗?你的方法有________(写一点即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】生铁用途十分广泛。工业上利用赤铁矿(主要成分是 Fe2O3,还含少量 SiO2 等杂质)冶炼生铁的过程如下:

回答下列问题:
(1)生铁属于_____材料(填“合成”或“金属”)。“高炉气体”中的_____(填化学式)会导致酸雨。
(2)“煅烧”时:
①生成 CO 的反应之一为 C + CO2 ![]() 2CO,该反应属于_____反应(填基本反应类型)。
2CO,该反应属于_____反应(填基本反应类型)。
②用化学方程式表示利用 CO 炼铁的原理_____。
③CaCO3 和 SiO2 固体在高温条件下发生反应,生成 CO2 气体和 CaSiO3,该反应的化学方程式为_____。
(3)生活中铁制品锈蚀的过程,实际上是 Fe 与空气中_____、_____等发生化学反应的过程。下列措施能防止铁制品锈蚀的是_____(填标号)。
A 涂油、喷漆 B 镀耐腐蚀的铬层
C 用盐水清洗 D .久置于酸性环境
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知![]() 是初中化学常见的物质,B与人体血红蛋白结合会引起煤气中毒,C是赤铁矿的主要成分,H是胃酸的主要成分,它们之间的关系如下图所示。(图中“
是初中化学常见的物质,B与人体血红蛋白结合会引起煤气中毒,C是赤铁矿的主要成分,H是胃酸的主要成分,它们之间的关系如下图所示。(图中“![]() ”表示物质间转化关系,“—”两端物质间能相互反应。)请回答下列问题:
”表示物质间转化关系,“—”两端物质间能相互反应。)请回答下列问题:
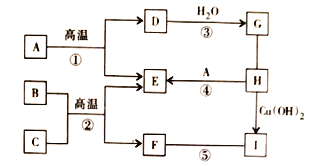
(1)写出I的化学式_____。
(2)判断⑤的反应类型_____。
(3)G的饱和溶液pH_____。
A 小于7 B 等于7 C 大于7 D 无法判断
(4)写出C与H反应的化学方程式_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com