
人体中钙元素主要存在于骨骼和牙齿中,以羟基磷酸钙晶体[Ca10(PO4)6(OH)2]形式存在,其相对分子质量为1004。牛奶含钙丰富又易吸收,且牛奶中钙和磷比例合适,是健骨的理想食品。右图是某乳业公司纯牛奶包装标签的部分文字。请仔细阅读后回答下列问题:
(1)包装标签上脂肪≥3.3g,是指100mL牛奶中含脂肪的质量至少3.3g.那么一盒牛奶含钙至少 g(保留到0.01g);
(2)求羟基磷酸钙中钙元素的质量分数(保留为0.1%);
(3)若人体每天至少需要0.6g钙,且这些钙有90%来自牛奶,则一个人每天至少要喝多少盒牛奶?
科目:初中化学 来源: 题型:计算题
如图所示,将0.1mol氧化铜与一定量的碳混合加热,充分反应(试管中的空气已被除去)。
(1)计算该实验最多可以生成多少克二氧化碳?(请根据化学方程式列式计算)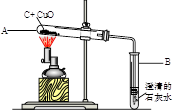
(2)实验前后分别称量了装置A和装置B的质量如表中所示。若数据Ⅰ准确,请回答:
a反应后A中固体的成分是_ 。
b数据Ⅱ存在的问题是_ ,可能的原因是 。
| | 反应前质量(g) | 反应后质量(g) | |
| Ⅰ | 装置A | 125.3 | 124.2 |
| Ⅱ | 装置B | 152 | 152.3 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
过氧化钠是常用的供氧剂,可将CO2转化为O2,其反应的化学方程式是:2Na2O2+2CO2=2Na2CO3+O2.若有88gCO2参加反应,计算生成O2的质量.
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
现有Cu与另一种金属(可能是Mg、Fe、Zn中的一种)形成的粉末。现欲测定其组成,进行如下实验:取该粉末16g放入烧杯,将溶质质量分数为14%的稀硫酸280.0g分4次加入该烧杯中,充分反应后,测得剩余的固体质量数据记录如下:
| 实验次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸质量/g | 70.0 | 70.0 | 70.0 | 70.0 |
| 剩余固体质量/g | 13.6 | 11.2 | 8.8 | 8.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
化肥的合理使用可以提高农作物的产量,兴化是农业大市,化肥的使用极其普遍。某农业生产公司部分氮肥的销售价格如下:硫酸铵[(NH4)2S04]800元/吨,尿素[CO(NH2)2]2400元/吨。某农民用800元钱去购买氮肥,为了使所购化肥得到的氮最多,你建议他应选购哪种氮肥(请写出计算过程)?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
如图是已破损的维生素C(简写Vc,)其化学式:C6H8OX,的说明书部分信息。已知维生素C由碳、氢、氧三种元素组成。请回答:
(1)Vc中碳、氢元素的质量比为 ;
(2)Vc的化学式为 ;
(3)小辉妈妈每天服用该Vc片剂,小辉建议妈妈可食用西红柿来代替Vc片,若100g[西红柿含Vc30mg,则小辉妈妈每天食用西红柿 g即可达到服用上述Vc片的效果。
(4)最近根据市场调查发现不合格奶粉有所抬头。根据标准,合格奶粉每100克中含蛋白质约18克,蛋白质中氮元素的平均质量分数为16%,现测定某奶粉每100克中含有氮元素的质量为2.5克。则这种奶粉是否为“合格”奶粉?(列出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某同学为了测定实验室中氯酸钾样品的纯度,取2.5g该样品与0.5g二氧化锰混合.加热该混合物t1时间后(杂质不参加反应),冷却,称量剩余固体质量,重复以上操作,依次称得加热t2、t3、t4时间后剩余固体的质量,记录数据如下表:
| 加热时间 | t1 | t2 | t3 | t4 |
| 剩余固体质量(g) | 2.12 | 2.08 | 2.04 | 2.04 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(9分)盐酸和氯化坝的混合溶液40g,其中盐酸的溶质质量分数为10%.向混合溶液中加入9%的硫酸溶液20g恰好完全反应.计算:
(1)生成沉淀的质量是多少克?
(2)反应后所得溶液中盐酸的质量分数.(计算结果精确到0.1)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某研究小组欲检验草酸晶体样品分解产物并测定器质量分数(假设杂质不参与反应).草酸晶体(H2C2O4?2H2O)的理化性质见表.
(1)加热分解草酸晶体最适宜的装置是 (填图1字母序号).
(2)图2是验证热分解产物中含CO,CO2的装置
①仪器a和b的名称分别是 和 .
②证明存在CO2的现象是 ,证明存在CO的现象是 ,D中反应的化学方程式是 .
③装置A的作用是 ,气囊的作用是 .
(3)为测定样品中草酸晶体的质量分数,设计两种如下方案.
| 熔点 | 沸点 | 热稳定性 | 与碱反应 |
| 101°C~102°C | 150°C~160°C升华 | 100.1°C失去结晶水,175°C分解成CO2,CO,H2O | 与Ca(OH)2反应产生白色沉淀(CaC2O4) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com